
铝作为材料金属在现代社会中发挥着巨大的作用,铝的化合物在工农业生产及人们的日常生活中也具有广泛地作用。
(1)若将铝溶解,下列试剂中最好选用________(填编号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸
(2)工业制备金属铝利用含有杂质氧化铁和二氧化硅的铝土矿(主要成分为氧化铝)为原料,先制备Al(OH)3。方法是先在铝土矿中加入硫酸,过滤,然后在滤液中加入过量的NaOH溶液,再过滤,在滤液中通入________(一种过量的气体),该反应的离子方程式_______________________________________________。
(3)工业上用电解熔融Al2O3的方法制备金属铝,其阴极反应式为_________。
(4)我国首创以铝、空气、海水为能源的新型电池。该电池以取之不尽的海水为电解液,靠空气中的氧气使铝不断氧化而产生电流。这种海水电池的能量比“干电池”高20~50倍。该新型电池用于航海标志灯已研制成功,只要把灯放入海水中数秒钟,就会发出耀眼的白光。该电池的总反应为:4Al+3O2+6H2O===4Al(OH)3。其负极材料为________,正极反应式为_________________。
(5)碱式氯化铝(分子式可表示为Al2(OH)nCl(6-n)是一种新型无机混凝剂,该产品对工业污水、造纸水、印染水具有较好的净化效果。为确定碱式氯化铝分子式中的n值,可采用沉淀称量法。准确称取碱式氯化铝样品4.97 g,配制成500 mL溶液,用硝酸酸化后,然后逐滴加入过量的AgNO3溶液。然后对沉淀进行过滤、洗涤、干燥,称取沉淀物质量为14.35 g。 该碱式氯化铝中的n=________。
(1)B
(2)CO2  +CO2+2H2O===Al(OH)3↓+
+CO2+2H2O===Al(OH)3↓+
(3)Al3++3e-===Al
(4)铝 3O2 + 6H2O +12e-=== 12OH-
(5)1
【解析】(1)铝与浓硫酸在常温下发生钝化,加热溶解会产生有毒气体SO2,原料利用率低;稀硝酸能溶解铝但会产生NO气体,污染空气,硝酸利用率低;而铝与稀硫酸反应速率较快,产生的H2对空气无污染。(2)铝土矿中加入硫酸,过滤后的滤液中含有Al3+、Fe3+,加入过量NaOH溶液,前者可转化为 ,后者转化为Fe(OH)3沉淀,再过滤后的滤液中含有NaAlO2溶液,通入过量二氧化碳,转化为Al(OH)3。(3)电解熔融氧化铝时,阳极O2-失去电子生成O2,阴极Al3+得电子生成单质Al。(4)这种新型电池以Al为负极,发生的反应为4Al-12e-===4Al3+,空气中的氧气为正极,发生的反应为3O2+ 6H2O +12e-===12OH-。(5)根据题目提供的数据,利用Cl元素守恒可列等式:
,后者转化为Fe(OH)3沉淀,再过滤后的滤液中含有NaAlO2溶液,通入过量二氧化碳,转化为Al(OH)3。(3)电解熔融氧化铝时,阳极O2-失去电子生成O2,阴极Al3+得电子生成单质Al。(4)这种新型电池以Al为负极,发生的反应为4Al-12e-===4Al3+,空气中的氧气为正极,发生的反应为3O2+ 6H2O +12e-===12OH-。(5)根据题目提供的数据,利用Cl元素守恒可列等式:
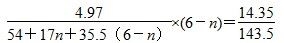
解得n=1。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案科目:高中化学 来源:2014高考名师推荐化学NA与粒子(解析版) 题型:选择题
某气体的摩尔质量为M g·mol-1,NA表示阿伏加德罗常数的值,在一定的温度和压强下,体积为V L的该气体所含有的分子数为X。则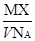 表示的是
表示的是
A.V L该气体的质量(以g为单位)
B.1 L该气体的质量(以g为单位)
C.1 mol该气体的体积(以L为单位)
D.1 L该气体中所含的分子数
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:选择题
对可逆反应N2(g)+3H2(g) 2NH3(g),△H=-92.4 kJ·mol-1下列叙述正确的是
2NH3(g),△H=-92.4 kJ·mol-1下列叙述正确的是
A.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大
B.若单位时间内消耗x mol N2,同时生成2x mol NH3,则反应达到平衡状态
C.达到平衡后,将容器体积减小为原来的一半,重新达到平衡后,c(NH3)变为原平衡时的2倍
D.若达到平衡时,共放出46.2kJ热量,则有l mo1NH3(g)生成
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:选择题
下列说法正确的是
A石油经过分馏及裂化等工序得到的物质均为纯净物
B乙酸乙酯、油脂、葡萄糖、蛋白质均可以发生水解反应
C乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同
D苯不能使酸性高锰酸钾溶液银色,说明苯分子中没有与乙烯分子中类似的碳碳双键
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:选择题
下列分类正确的是
A.共价化合物:硫酸、水、纯碱
B. 非电解质:乙醇、二氧化碳、氨气
C. 胶体:饱和氯化铁溶液、豆浆、牛奶
D.硅酸盐产品:水晶、玻璃、陶瓷
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测6 题型:简答题
【物质结构与性质】
碳、氮、氧是构成生命物质的三种主要元素。
(1)碳、氮、中,原子核外电子未成对电子数最多的是 (用元素符号表示)。
(2)已知CN-与N2结构相似,则HCN分子中σ键与π键数目之比为 。
(3)H2O2分子中氧原子的杂化方式为 。
(4)与NO2+互为等电子体的微粒有 、 (举2例),NO3-的空间构型是 。
(5)已知元素A的氧化物的晶胞结构如图所示,则该氧化物的化学式为 。
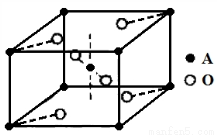
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测6 题型:选择题
锅炉水垢是一种安全隐患,除去水垢中的CaSO4,可先用Na2CO3溶液处理,使之转化为易溶于酸的CaCO3,而后用酸除去。下列说法不正确的是:
A.CaCO3的溶解度小于CaSO4
B.沉淀转化的实质是沉淀溶解平衡的移动
C.沉淀转化的难易与溶解度差别的大小无关
D.CaSO4到CaCO3的沉淀转化中并存着两个沉淀溶解平衡
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
A.78 g 苯含有碳碳双键的数目为3NA
B.常温常压下,22.4 L二氧化碳含有的原子总数为3NA
C.1 mol Fe与足量稀HNO3反应,转移3 NA个电子
D.1 L 1 mol·L-1的NaClO 溶液中含有ClO-的数目为NA
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:选择题
下列事实不能用金属活动性解释的是
A.生活中可用铝制的水壶烧水
B.镀锌铁制品破损后,镀层仍能保护铁制品
C .工业上常用热还原法冶炼铁,用电解法冶炼钠
.工业上常用热还原法冶炼铁,用电解法冶炼钠
D.电解法精炼铜时,其含有的Ag、Au杂质沉积在电解槽的底部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com