
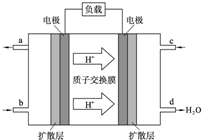
 以甲烷(CH4)、合成气(CO和H2)、CO2、甲醇(CH3OH)、甲醛(HCHO)等为初始反应物可以反应合成一系列重要的化工原料和燃料.其中作为初始反应物的甲醇是一种可再生能源,具有广泛的开发和应用前景.
以甲烷(CH4)、合成气(CO和H2)、CO2、甲醇(CH3OH)、甲醛(HCHO)等为初始反应物可以反应合成一系列重要的化工原料和燃料.其中作为初始反应物的甲醇是一种可再生能源,具有广泛的开发和应用前景.| 温 度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 1.6mol |
| 2mol |
| ||||
|
| ①-② |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,23g NO2含有NA个氧原子 |
| B、标准状况下,11.2L SO3中含有的分子数为0.5NA |
| C、1mol Cl2做氧化剂转移的电子数是NA |
| D、1L0.1mol?L-1的氨水中含OH-离子数为0.1NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | A | B | C | D | E | F |
| 化合价 | -2 | -1 | -2、+6 | +4、-4 | +3 | +1 |
| 原子半径(nm) | 0.074 | 0.099 | 0.102 | 0.117 | 0.143 | 0.186 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、凡是生成盐和水的反应都是中和反应 |
| B、复分解反应一定没有单质参加 |
| C、生成一种单质和一种化合物的反应一定是置换反应 |
| D、分解反应一定不是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com