
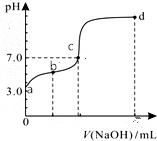
 常温下向20mL0.1mol/LHA溶液中逐滴加入0.1mol/LNaOH溶液,其pH变化情况如图所示(忽略温度变化).下列说法中不正确的是( )
常温下向20mL0.1mol/LHA溶液中逐滴加入0.1mol/LNaOH溶液,其pH变化情况如图所示(忽略温度变化).下列说法中不正确的是( )| A. | 由题可知HA为弱酸 | |
| B. | 滴定终点位于c和d点之间 | |
| C. | 滴定到b点时:n(Na+)+n(H+)-n(OH-)+n(HA)=0.002mol | |
| D. | 滴定到d点时:c(OH-)>c(Na+)>c(A-)>c(H+) |
分析 A、20mL0.1mol/LHA溶液pH=3,所以酸是弱酸;
B、酸为弱酸,恰好中和时溶液呈碱性,pH>7,溶液呈中性,需要酸稍过量;
C、任何溶液一定满足电荷守恒,b点溶液显酸性,析根据电荷守恒、物料守恒进行判断;
D、根据氢氧化钠和醋酸钠溶液中离子浓度的大小关系来回答.
解答 解:A、20mL0.1mol/LHA溶液pH=3,所以酸是弱酸,故A正确;
B、向20mL0.1mol/LHA溶液中逐滴加入0.1mol/LNaOH溶液,恰好中和时溶液呈碱性,pH>7,溶液呈中性,需要酸稍过量,滴定终点位于c和b点之间,故B错误;
C、滴定到b点时,根据电荷守恒:n(Na+)+n(H+)-n(OH-)=n(A-),n(A-)+n(HA)=0.002mol,即n(Na+)+n(H+)-n(OH-)+n(HA)=0.002mol,故C正确;
D、d点所的溶液是氢氧化钠和NaA溶液的混合物,c(Na+)>c(A-),氢氧化钠剩余,c(Na+)>c(OH-)>c(A-)>c(H+),故D错误,
故选BD.
点评 本题考查了酸碱混合的定性判断、离子浓度大小比较,题目难度中等,能够根据电荷守恒、物料守恒比较溶液中离子浓度大小.


科目:高中化学 来源: 题型:选择题
| A. | 常温下,1 L pH=1的硫酸溶液中含有的H+为0.1NA | |
| B. | 常温下,14g C2H4和C3H6的混合气体中含有2NA个氢原子 | |
| C. | 2.3 g Na和足量的O2完全反应,在常温和燃烧时,转移电子数均为0.1NA | |
| D. | 在含有4molSi-O键的石英晶体中,氧原子的数目为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 105g | B. | 106.1g | C. | 107.6g | D. | 108.3g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z-+H2O?HZ+OH- | B. | HY?H++Y- | ||
| C. | 常温下,电离程度:HX>HY>HZ | D. | Z-+HX?HZ+X- |
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上第二次适应性考试化学卷(解析版) 题型:填空题
粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1) ①中引发铝热反应的实验操作是_____________,产物中的单质B是_____________。
①中引发铝热反应的实验操作是_____________,产物中的单质B是_____________。
(2)②中所发生的各反应的化学方程式是_______________________。
(3)③中所发生的各反应的离子方程式是_________________________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为__________,c(Fe2+)为__________。
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上第二次适应性考试化学卷(解析版) 题型:选择题
下列有关金属及其合金的说法不正确的是
A.目前我国流通的硬币是由合金材料制造的
B.生铁、普通钢和不锈钢中的碳含量依次增加
C.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
D.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上第二次适应性考试化学卷(解析版) 题型:选择题
下列叙述正确的是
A.48gO3气体含有6.02×1023个O3分子
B.常温常压下,4.6gNO2气体含有1.81×1023个 NO2分子
NO2分子
C.0.5mol·L-1CuCl2溶液中含有3.01×1023个Cu2+
D.标准状况下,33.6LH2O含有9.03×1023个H2O分子
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部由非金属元素组成的化合物一定是共价化合物 | |
| B. | 含有共价键的化合物不一定是共价化合物 | |
| C. | 由共价键形成的分子一定是共价化合物 | |
| D. | 硫酸分子中有H+和SO42-两种离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com