
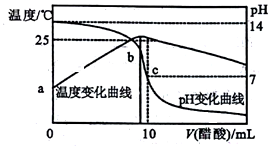
 在某温度时,将nmol•L-1醋酸溶液滴入10mL1.0mol•L-1NaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将nmol•L-1醋酸溶液滴入10mL1.0mol•L-1NaOH溶液中,溶液pH和温度随加入醋酸溶液体积变化曲线如图所示,下列有关说法正确的是( )| A. | 水的电离程度:c>b | B. | a点Kw比b点大 | ||
| C. | n>1.0 | D. | c点:Ka(CH3COOH)=$\frac{10}{10n+1}$×10-8 |
分析 A.b点溶液温度最高,则溶质为醋酸钠;c点是在b点后继续加入醋酸,溶质为醋酸钠和醋酸,酸或碱抑制水电离、含有弱离子的盐促进水电离;
B、水的电离是吸热过程,温度越高Kw越大;
C.酸碱中和为放热反应,二者恰好完全反应时温度最高,根据图知,温度最高时需要的醋酸体积小于10mL,此时醋酸和NaOH的物质的量相等;
D、根据Ka(CH3COOH)=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$进行计算.
解答 解:A.b点溶液温度最高,则溶质为醋酸钠;c点是在b点后继续加入醋酸,溶质为醋酸钠和醋酸,酸或碱抑制水电离、含有弱离子的盐促进水电离,b点促进水电离、c点抑制水电离,所以水的电离程度:c<b,故A错误;
B、水的电离是吸热过程,温度a小于b,所以a点Kw比b点小,故B错误;
C.酸碱中和为放热反应,二者恰好完全反应时温度最高,根据图知,温度最高时需要的醋酸体积小于10mL,此时醋酸和NaOH的物质的量相等,则n>1.0,故C正确;
D、c点:溶液的pH=7,则c(H+)=10-7 mol•L-1,根据电荷守恒可知:c(CH3COO-)=c(Na+)=$\frac{0.01}{0.02}$=0.5mol/L,c(CH3COOH)=(0.5n-0.5)mol/L,所以Ka(CH3COOH)=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{0.5×1{0}^{-7}}{0.5n-0.5}$=$\frac{10}{10n-1}$×10-8,故D错误;
故选C.
点评 本题考查酸碱混合溶液定性判断,侧重考查学生分析、判断能力,明确反应过程中温度与反应的关系、溶液中溶质成分及其性质是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 适当降低温度 | B. | 将锌粒改为铜粉 | ||
| C. | 将所用硫酸改为98.3%浓硫酸 | D. | 滴加少量CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500mL0.l mol/LFeCl3溶液中含Fe3+0.05NA | |
| B. | 常温常压下,2.24L氯气溶于NaOH溶液中,转移电子数为0.lNA | |
| C. | 常温常压下,28g乙烯中所含C-H键的数目为4NA | |
| D. | 0.5 mol锌与浓硫酸完全反应生成SO2和H2的混合气体(不考虑气体溶解),气体的分子总数小于0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
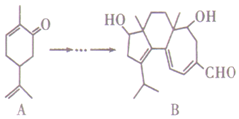 如图,有机物B对治疗神经系统疾病有着很好的疗效,可用有机物A经过多步反应合成.下列说法不正确的是( )
如图,有机物B对治疗神经系统疾病有着很好的疗效,可用有机物A经过多步反应合成.下列说法不正确的是( )| A. | A的化学式为C10H14O | |
| B. | 与A互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有4种 | |
| C. | A和B均能使酸性KMnO4溶液褪色 | |
| D. | B可以发生加成反应、消去反应和氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | b极发生还原反应 | |
| B. | a极的电极反应:CH3OH+H2O-6e-═CO2+6H+ | |
| C. | 总反应方程式为:2CO2+4H2O$\frac{\underline{\;通电\;}}{\;}$2CH3OH+3O2 | |
| D. | 该装置将化学能转变为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3受热易分解,可用作氮肥 | |
| B. | Na2CO3具有碱性,可用作胃酸中和剂 | |
| C. | SiO2易传导光信号,可用作光导纤维 | |
| D. | Ca(ClO)2在空气中不稳定,可用于漂白纸张 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图中T1>T2 | |
| B. | XZ线上任意点均有pH<7 | |
| C. | 两条曲线间任意点均有c(H+)×c(OH+)═KW=1×10-13 | |
| D. | M区域内任意点对应的溶液中下列离子均可大量共存:S2-、SO42-、Na+、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com