
【题目】在最新的家用汽车的调查中发现,新车中气体的质量不符合标准.汽车污染主要来源于汽车配件及材料,它们都会产生大量的有毒有机物.其中一种有毒物质A,为了测定有机物A的结构,做如下实验:
①将9.2g该有机物完全燃烧,生成标况下15.68L的CO2和7.2g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;
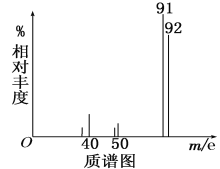
(1)则由图可知该分子的相对分子质量是________,有机物A的分子式为_________。
(2)用核磁共振仪处理该化合物,得到如下图所示图谱,图中四个峰的面积之比是1∶2∶2:3,则有机物的名称为________,写出该物质和浓硝酸浓硫酸混合物制烈性炸药的反应方程式________反应类型_______
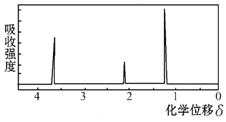
【答案】92 C7H8 甲苯  取代反应
取代反应
【解析】
(1)根据质谱图中最右边的那个峰就是该物质的相对分子质量,再根据①的质量与产生CO2和水的体积与质量确定其分子式;
(2)根据核磁共振氢谱中有4个吸收峰,结合物质的分子式可判断出该物质是甲苯。
(1)由质谱图可以看出最大质核比为92,说明该气体的相对分子质量为92,9.2g该有机物的物质的量为0.1mol,0.1mol该有机物完全燃烧,生成标况下15.68L的CO2和7.2g水,n(C)=![]() =0.7mol,含有H原子的物质的量为n(H)=2n(H2O)=2
=0.7mol,含有H原子的物质的量为n(H)=2n(H2O)=2![]() =0.8mol,则1mol该有机物中含有C原子为7mol,含有H原子的物质的量为8mol,12×7+1×8=92,恰好等于物质的相对分子质量,因此该有机物的分子式C7H8,故答案为:92,C7H8。
=0.8mol,则1mol该有机物中含有C原子为7mol,含有H原子的物质的量为8mol,12×7+1×8=92,恰好等于物质的相对分子质量,因此该有机物的分子式C7H8,故答案为:92,C7H8。
(2)由核磁共振氢谱中有4个吸收峰,四个峰的面积之比是1∶2∶2:3,结合物质的分子式可判断出该物质是甲苯,甲苯与浓硝酸浓硫酸的混合物反应生成三硝基甲苯,制烈性炸药,反应方程式为: ,该反应为取代反应,故答案为:甲苯,
,该反应为取代反应,故答案为:甲苯, ,取代反应。
,取代反应。


科目:高中化学 来源: 题型:
【题目】某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。

①该反应的化学方程式是______。
②0~2min时用X来表示该反应的平均速率为______。
③该反应达到平衡状态的标志是______ (填字母)。
A.X、Y的反应速率比为3∶1
B.Y的物质的量浓度在混合气体中保持不变
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1molY的同时消耗2molZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,若电解5 min时,测得铜电极的质量增加2.16 g。试回答:
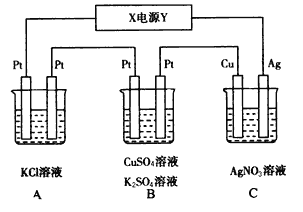
(1)电源中Y极是____(填“正”或“负”)极,C中银电极发生的电极反应式是___
(2)通电5 min时,B中共收集到224 mL(标准状况)气体,B中阳极发生的电极反应式___。溶液体积为200 mL(电解前后溶液的体积变化忽略不计),则通电前c(CuSO4)=______。
(3)若A中KCl溶液的体积也是200 mL,电解后溶液中仍有Cl-,则电解5 min后,共产生气体的体积为(标准状况)___,此时溶液c(OH-)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按图装置进行制取。
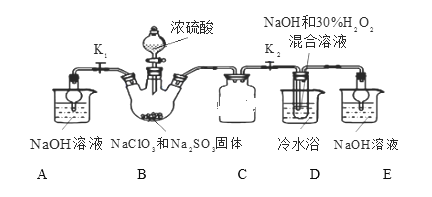
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,38-60℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是___________________。
(2)B中产生ClO2的化学方程式_________________________。
(3)装置D中反应生成NaClO2的化学方程式为____________ 。反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH—外还可能含有的一种阴离子是_______,检验该离子的方法是____________。
(4)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②______________;③______________;④______________;得到成品。
(5)如果撤去D中的冷水浴,可能导致产品中混有的杂质是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.28g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到VmL气体(标准状况),将盛有此气体的容器倒扣在水中,通入氧气恰好使气体完全溶解在水中,则需要标准状况下的氧气体积为( )
A. 504mLB. 336mLC. 224mLD. 168mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NF3(三氟化氮)在常温常压下是无色、无味的气体,是微电子工业中一种优良的等离子蚀刻气体。回答下列问题:
(1)NF3的电子式为______,N元素的化合价为______。
(2)F2与NH3直接反应生成NF3的化学方程式为______。
(3)实验室模拟工业上利用电解熔融NH4HF2(NH4FHF)法制取NF3,阳极为以Ni为基本材料的合金(内含其他金属,忽略镍及其他金属的反应),阴极为碳素钢,电解废液可回收再利用。
①电解时NF3在______极生成;阴极产生的气体是______(填化学式)。
②电解后废液(含Ni少量Fe和Cu的单质及NH4HF2等)可经如下流程进行回收再利用:
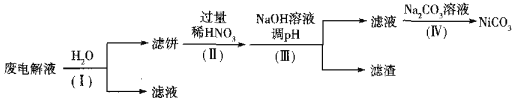
已知该实验条件下,部分金属离子开始沉淀与沉淀完全的pH如下表
金属离子 | Ni2+ | Fe2+ | Cu2+ | Fe3+ |
开始沉淀时的pH | 7.2 | 7.0 | 4.7 | 1.9 |
沉淀完全时的pH | 9.2 | 9.0 | 6.7 | 3.2 |
步骤I的目的是______;步骤Ⅱ滤饼中Ni溶于硝酸的离子方程式为______(HNO3的还原产物为NO);步骤Ⅲ调节pH时,理论上pH应控制的范围是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可以通过电解NO2制备NH4NO3,其工作原理如图所示,下列说法正确的是

A. 电解过程中,阴极区NO2流入速率比阳极区NO2流入速率快些
B. 阴极区消耗1molNO2需补充6mol化合物X
C. 阳极反应为:NO2+e-+H2O=NO3-+2H+
D. 电解过程中,阴极区的pH小于阳极区的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用氯氧化法处理含氰(![]() )废水,一定条件下,氯气和
)废水,一定条件下,氯气和![]() 反应生成无毒气体。下列说法不正确的是
反应生成无毒气体。下列说法不正确的是
A. ![]() 中碳元素的化合价为+2
中碳元素的化合价为+2
B. 该反应的产物之一是无毒的![]()
C. 当1mol![]() 参与反应时,转移
参与反应时,转移![]()
D. 处理含0.1mol![]() 的废水,理论上需要消耗标准状况下
的废水,理论上需要消耗标准状况下![]() 的体积为5.6L
的体积为5.6L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com