
| A. |  和 和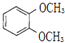 不属于同分异构体的 不属于同分异构体的 | |
| B. | 质量相同的C3H6 和C2H6完全燃烧时消耗氧气的质量较少的是C3H6 | |
| C. | 连接四个不同基团的碳原子为“手性碳原子”,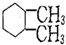 含有两个手性碳原子 含有两个手性碳原子 | |
| D. | 标准状况下22.4 L溴乙烷所含化学键总数为7NA |
分析 A.苯的邻位二元取代产物没有同分异构体;
B.质量相等的条件下,烃分子中氢元素的含量越多,消耗的氧气就越多,在最简式CHn中,n越大,含氢量越高;
C.根据有机分子中碳原子连四个不同的原子或原子团时,称为不对称碳原子,结合结构来判断;
D.根据溴乙烷在标准状况下不是气体进行判断.
解答 解:A.苯的邻位二元取代产物没有同分异构体,所以 和
和 是同种物质,故A正确;
是同种物质,故A正确;
B.C3H6 和C2H6的最简式分别为CH2、CH3,质量相等的条件下,烃分子中氢元素的含量越多,消耗的氧气就越多,所以消耗氧气的量最少的是C3H6,故B正确;
C. 分子中,4个亚甲基上碳原子所连接的4个基团2个是一样的H,有2个甲基上的碳原子所连的4个取代基3个是一样的H,有2个次甲基上的碳原子所连的四个取代基不同,有2个手性碳原子,故C正确;
分子中,4个亚甲基上碳原子所连接的4个基团2个是一样的H,有2个甲基上的碳原子所连的4个取代基3个是一样的H,有2个次甲基上的碳原子所连的四个取代基不同,有2个手性碳原子,故C正确;
D.标况下,溴乙烷不是气体,不能使用标况下的气体摩尔体积计算溴乙烷的物质的量,故D错误.
故选D.
点评 本题考查有机物的结构与性质、阿伏加德罗常数的有关计算,把握有机物的燃烧的计算和判断、有机物的结构特点为解答的关键,注重基础知识的考查,难度不大.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | 增大容器体积 | B. | 体积不变,充入N2使压强增大 | ||
| C. | 体积不变,充入He使压强增大 | D. | 压强不变,充入N2使体积增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:O>N | B. | 水溶性:CH3CH2OH>CH3OCH3 | ||
| C. | 沸点:H2S>H2O | D. | 晶格能:NaCl>MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2014年诺贝尔物理学奖得主的贡献是发明了一种高效而环保的光源--蓝色发光二极管(LED).某同学对此非常感兴趣,请你帮助某同学完成资料收集的工作.
2014年诺贝尔物理学奖得主的贡献是发明了一种高效而环保的光源--蓝色发光二极管(LED).某同学对此非常感兴趣,请你帮助某同学完成资料收集的工作.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①②④ | D. | ②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com