
| A. | Na2CO3溶液(NaHCO3),加入适量的NaOH溶液 | |
| B. | Na2CO3溶液(Na2SO4),加入适量的Ba(OH)2溶液后过滤 | |
| C. | NaHCO3溶液(Na2CO3),通入过量的CO2气体 | |
| D. | Na2O2粉末(Na2O),将混合物在空气中加热 |
分析 A.碳酸氢钠与NaOH反应生成碳酸钠;
B.氢氧化钡与硫酸钠反应生成硫酸钡和NaOH;
C.碳酸钠、水、二氧化碳反应生成碳酸氢钠;
D.氧化钠与氧气反应生成过氧化钠.
解答 解:A.碳酸氢钠与NaOH反应生成碳酸钠,则加入适量的NaOH溶液可除杂,故A正确;
B.氢氧化钡与硫酸钠反应生成硫酸钡和NaOH,引入新杂质NaOH,故B错误;
C.碳酸钠、水、二氧化碳反应生成碳酸氢钠,则通入过量的CO2气体可除杂,故C正确;
D.氧化钠与氧气反应生成过氧化钠,则将混合物在空气中加热可除杂,故D正确;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 64g SO2含有氧原子数为NA | |
| B. | 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为NA | |
| C. | 0.5NA个O2的质量为32g | |
| D. | 常温常压下,14g N2含有分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
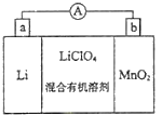 如图是锂锰电池的反应原理示意图,其中电解质KClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,得到LiMnO2.回答下列问题:
如图是锂锰电池的反应原理示意图,其中电解质KClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,得到LiMnO2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 浓硫酸和浓盐酸混合可制氯化氢,说明浓硫酸是一种难挥发性的酸 | |
| C. | 常温下,浓硫酸可以用铝罐储存,说明铝与浓硫酸不反应 | |
| D. | 在化学反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O中浓H2SO4只表现氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
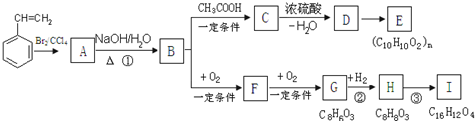
 .
.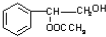 或
或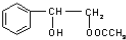 .
.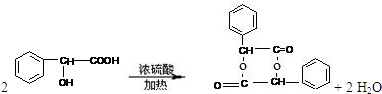 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com