
【题目】下表是元素周期表的一部分,表中的每个编号表示一种元素,请根据要求回答问题

(1)⑤和⑥两种元素的原子半径大小是⑤____⑥(填“<"或“>”);
(2)由①和②两种元素组成的最简单化合物的化学式是________;
(3)⑥的单质与⑤的最高价氧化物的水化物的水溶液反应的化学方程式为____________。
【答案】 > CH4 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
【解析】试题分析:本题考查元素周期表的结构,原子半径大小的比较,化学方程式的书写。根据各编号在周期表中的位置知,①、②、③、④、⑤、⑥、⑦、⑧依次代表的元素是H、C、N、O、Na、Al、S、Cl。
(1)⑤和⑥分别是Na和Al,Na和Al都是第三周期元素,Na在IA族,Al在IIIA族,根据同周期主族元素从左到右原子半径依次减小,rNa![]() rAl,⑤
rAl,⑤![]() ⑥。
⑥。
(2)①为H元素,②为C元素,H和C组成的化合物为烃,最简单的化合物的化学式为CH4。
(3)⑤为Na元素,Na的最高价氧化物的水化物为NaOH,⑥为Al元素,Al与NaOH溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g) ![]() CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
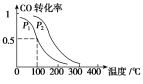
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示。
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
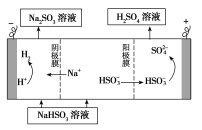
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。请写出开始时阳极反应的电极反应式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
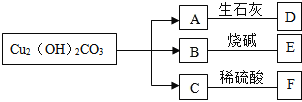
【题目】孔雀石的主要成分是Cu2(OH)2CO3,受热分解生成三种氧化物,并有如图所示的转化关系:
回答问题:
(1)D在农业生产中的用途是__________________;
(2)写出碱式碳酸铜受热分解的化学方程式:____________________;
(3)D和E反应的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X,Y均为1~18号之间的元素,X,Y可形成化合物X2Y和X2Y2 , 又知Y的原子序数小于X的原子序数,则两种元素的原子序数之和为( )
A.19
B.18
C.27
D.9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
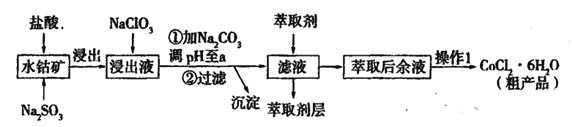
已知:①浸出液含有的阳离子主要有,H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe( OH)3 | Fe(OH)2 | Co(OH)2 | Al( OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)①浸出过程中加入Na2SO3的目的是____。
②向浸出液中加入NaClO3的离子反应方程式为____。
③为提高浸取率除了适当增大NaClO3浓度,升高温度还可采取措施____(答一条即可)。若不慎向“浸出液”中加入NaClO3过量时,可能会生成有毒气体,写出生成该有毒气体的离子方程式____。
(2)①“加Na2CO3调pH至a”,过滤所得到的沉淀成分为____。
②萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是____;其使用的适宜pH范围是____(填编号)。
A.2.0—2.5 B. 3.0—3.5 C.4.0—4.5 D.5.0—5.5
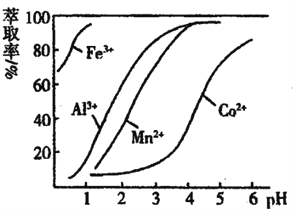
③“操作1”中包含的基本实验操作,它们依次是_______、____和过滤、减压烘干。
(3)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤,洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是____(答一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据:4Al(s)+3O2(g)=2Al2O3(s) △H=-3350kJ·mol-1
2Fe(s)+O2(g)=2FeO(s) △H=-544kJ·mol-1
则2Al(s) +3FeO(s)=Al2O3(s) + 3Fe(s)的△H是( )
A. +1403 kJ·mol-1 B. -859 kJ·mol-1
C. -1718 kJ·mol-1 D. -2806kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘与氢气反应的有关热化学方程式如下,下列说法正确的是
① I2(g)+H2(g) ![]() 2HI(g) △H=-9.48 kJ·mol–1
2HI(g) △H=-9.48 kJ·mol–1
② I2(s)+H2(g) ![]() 2HI(g) △H=+26.48 kJ·mol–1
2HI(g) △H=+26.48 kJ·mol–1
A.①的产物比②的产物稳定
B.②的反应物总能量比①的反应物总能量低
C.I2(s) ![]() I2(g) △H=+17.00 kJ·mol–1
I2(g) △H=+17.00 kJ·mol–1
D.在装有1mol I2(g)的密闭容器中通入1 mol H2(g),发生反应时放热9.48 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置的说法正确的是( )

A. 装置①中盐桥内的K+移向ZnSO4溶液
B. 若装置②用于铁棒镀铜,则M极为铁棒
C. 若装置②中N极为铁棒,M极为石墨,则铁棒不易被腐蚀
D. 若装置②用于电解精炼铜,则溶液中Cu2+浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃A有如下转化关系:

(1)写出反应②和⑤的反应条件:②______________;⑤_______________.
(2)写出A的结构简式:____________________;
(3)写出反应⑥的化学方程式:________________________________________.
(4)反应③的反应类型_________________.
(5)根据已学知识和获取的信息,写出以CH3COOH,![]() 为原料合成重要的化工产品
为原料合成重要的化工产品 的路线流程图(无机试剂任选) 合成路线流程图示例如下:
的路线流程图(无机试剂任选) 合成路线流程图示例如下:

_________________________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com