
已知物质A、B、C、D、E、F在一定条件下的关系如下图所示,该六种物质的焰色反应均呈黄色。
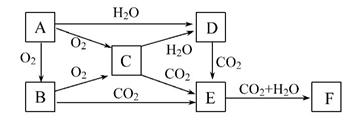
(1)写出下列物质的化学式:A 、D 、F 。
(2)A、B、C、D四种物质分别长期暴露在空气中,其最终产物为 ,其中变质过程中有氧化还原反应发生的两种物质是(填写物质对应的化学式) 、 。
(3)将C加入CuSO4溶液中,发生反应的总化学方程式为 。
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
下列有关说法正确的是( )
A.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
B.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v (H2)和氢气的平衡转化率均增大
2NH3(g) △H<0,其他条件不变时升高温度,反应速率v (H2)和氢气的平衡转化率均增大
C.升高温度通过降低活化能而加快化学反应速率
D.常温下,反应C(s)+CO2(g) === 2CO(g)不能自发进行,则该反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求填空:
(1)2.7 g H2O所含氢原子数与 ▲ L(标准状况下)NH3所含氢原子数相等。
(2)以下物质:① NH3 ② CaCO3 ③ 蔗糖 ④ 饱和食盐水 ⑤ H2SO4 ⑥ Cu
属于电解质的有 ▲ (填序号)。
(3)用单线桥标出下列反应中电子转移的方向和数目:
MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
① 该反应中的氧化剂是 ▲ 。
②如反应中转移了0.2 mol电子,则产生的Cl2在标准状况下体积为 ▲ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
把0.6mol铜粉投入含0.8mol硝酸和0.2mol硫酸的稀溶液中,则标状况下放出的气体的物质的量为( )
A.0.2 mol B.0.3 mol C.0.4 mol D.0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列判断错误的是( )
A.稳定性:HBr> HCl> HF B.溶解度:Na2CO3>NaHCO3
C.还原性:PH3>H2S> H2O D.碱性:NaOH >Mg(OH)2 >Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积不变的密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )
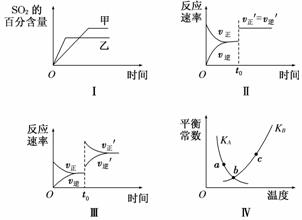
A.图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B.图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C.图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
在1.0 L密闭容器中放入0.10 mol A (g),在一定温度进行如下反应:A(g)B(g)+C(g) ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p /100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为________。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为________________________________________________________________________,
平衡时A的转化率为________,列式并计算反应的平衡常数K_______________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总=________mol,n(A)=________mol。
②下表为反应物A浓度与反应时间的数据,计算a=__________________。
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是________,由此规律推出反应在12 h时反应物的浓度c(A)为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,取0.2 mol·L-1HX溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH = 8,则下列说法(或关系式)正确的是( )
A.c(Na+)-c(X-)=9.9×10-7mol·L-1
B.c(Na+)=c(X-)+c(HX)=0.2 mol·L-1
C.c(OH-)-c(HX)=c(H+)=1×10-6mol·L-1
D.混合溶液中由水电离出的c(OH-)=10-8mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
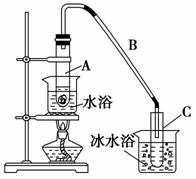
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。
已知:
| 密度/(g·cm-3) | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | —103 | 83 | 难溶于水 |
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是________,导管B除了导气外还具有的作用是________________________________________________________________。
②试管C置于冰水浴中的目的是______________________________________
__________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用________(填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图装置蒸馏,冷却水从________口进入。蒸馏时要加入生石灰,目的是______________________________________________________
________________________________________________________________。
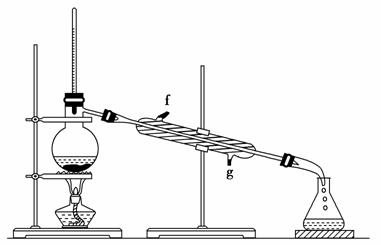
③收集产品时,控制的温度应在________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是________。
a.蒸馏时从70 ℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com