
| A. | NaClO溶液:ClO-+H2O═HClO+OH- | B. | FeCl3溶液:Fe3++3H2O?Fe(OH)3↓+3H+ | ||
| C. | Na2S溶液:S2-+H2O?H2S+2OH- | D. | NH4Cl溶液:NH4++H2O?NH3•H2O+H+ |
分析 A.水解为可逆反应;
B.水解为可逆反应,且水解程度小,不生成沉淀;
C.硫离子水解分步进行,以第一步为主;
D.铵根离子水解生成一水合氨和氢离子.
解答 解:A.NaClO的溶液中水解离子反应为ClO-+H2O?HClO+OH-,故A错误;
B.FeCl3的溶液中水解离子反应为Fe3++3H2O?Fe(OH)3+3H+,故B错误;
C.Na2S的溶液的水解离子反应为S2-+H2O?HS-+OH-,故C错误;
D.NH4Cl的溶液中的水解离子反应为NH4++H2O?NH3•H2O+H+,故D正确;
故选:D.
点评 本题考查离子反应方程式的书写,明确水解为可逆反应及弱酸根离子水解特点即可解答,侧重水解离子反应的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | AlCl3、KOH | B. | KAlO2、HCl | C. | KHCO3、HNO3 | D. | Na2CO3、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减小、减小、增大 | B. | 减小、增大、增大 | C. | 增大、减小、减小 | D. | 减小、增大、减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
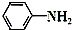 +CH3COOH$\stackrel{△}{→}$
+CH3COOH$\stackrel{△}{→}$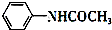 +H2O
+H2O| 试剂名称 | 熔点℃ | 沸点℃ | 溶解度(20℃) |
| 苯胺 | -6.2 | 184.4 | 稍溶于水(3.4g),与乙醇、乙醚、苯混溶 |
| 乙酸 | 16.7 | 118 | 易溶于水、乙醇、乙醚等 |
| 乙酰苯胺 | 114~116 | 280~290 | 0.46g |
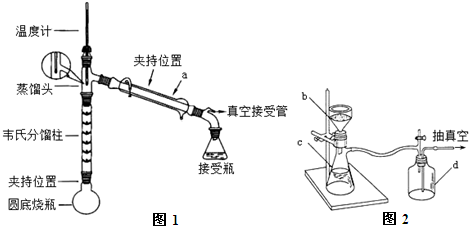
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
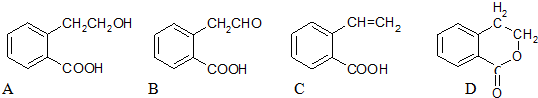

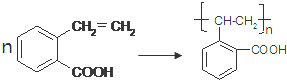 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
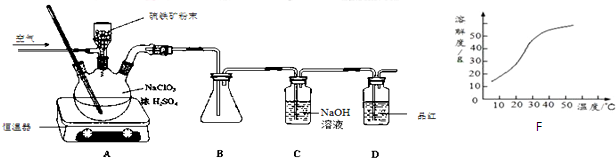
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
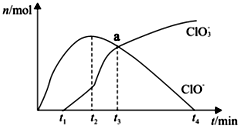 工业上将Cl 2通入冷的NaOH溶液中制得漂白液 (主要成分是NaClO ),室温下将Cl 2缓缓通入NaOH溶液中,得到ClO -、ClO 3-的物质的量与反应时间的关系如图所示,下列有关说法正确的是( )
工业上将Cl 2通入冷的NaOH溶液中制得漂白液 (主要成分是NaClO ),室温下将Cl 2缓缓通入NaOH溶液中,得到ClO -、ClO 3-的物质的量与反应时间的关系如图所示,下列有关说法正确的是( )| A. | HClO具有强氧化性,而NaClO没有氧化性 | |
| B. | 向漂白液中加入足量浓盐酸可增强漂白效果 | |
| C. | 无法求出a点时的溶液中,c( Na+ )和 c(Cl-)的比值 | |
| D. | t 2到t 4,n( ClO - )下降的原因可能是:3ClO -═2Cl-+ClO 3 - |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com