
【题目】将4 mol A气体和2 mol B气体在体积为2 L的密闭容器中混合,并在一定条件下发生反应:2A(g)+B(g) ![]() xC(g),若经2 s后测得A的物质的量为2.8 mol,C的物质的量浓度为0.6 mol/L。现有下列几种说法:
xC(g),若经2 s后测得A的物质的量为2.8 mol,C的物质的量浓度为0.6 mol/L。现有下列几种说法:
①2 s内用物质A表示的平均反应速率为0.3 mol/(L·s);
②2 s内用物质B表示的平均反应速率为0.15 mol/(L·min)
③2 s时物质B的转化率为70%;
④x=2。
其中正确的是:
A. ①④ B. ②③ C. ①②③ D. ①②④
【答案】A
【解析】
2s后生成C为0.6mol/L×2L=1.2mol,
2A(g)+B(g)xC(g)
开始 4mol 2mol 0
转化 1.2mol 0.6mol 1.2mol
2s 2.8mol 1.4mol 1.2mol
2s内用物质C表示的平均反应速率为![]() =0.3mol/(Ls)。①2s内用物质A表示的平均反应速率为
=0.3mol/(Ls)。①2s内用物质A表示的平均反应速率为![]() =0.3mol/(Ls),故①正确;②反应速率之比等于化学计量数之比,则2s内用物质B表示的平均反应速率为0.3mol/(Ls)×
=0.3mol/(Ls),故①正确;②反应速率之比等于化学计量数之比,则2s内用物质B表示的平均反应速率为0.3mol/(Ls)×![]() =0.15mol/(Ls),故②错误;③2s时物质B的转化率为
=0.15mol/(Ls),故②错误;③2s时物质B的转化率为![]() ×100%=30%,故③错误;④反应速率之比等于化学计量数之比,A、C的反应速率相同,则x=2,故④正确;故选A。
×100%=30%,故③错误;④反应速率之比等于化学计量数之比,A、C的反应速率相同,则x=2,故④正确;故选A。


科目:高中化学 来源: 题型:
【题目】Ⅰ、反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题.

(1)该反应是_________反应(填“吸热”、“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率_______(填“增大”、“减小”、“不变”)。
(3)反应体系中加入催化剂对反应热是否有影响?_____(填“有”、“无”),原因是____。
(4)在反应体系中加入催化剂,反应速率增大,E1的变化是:E1____(填“增大”、“减小”、“不变”)。
Ⅱ、五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:PCl3(g)+Cl2(g) ![]() PCl5(g) △H=-0.930 kJmol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
PCl5(g) △H=-0.930 kJmol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)50~150s内的平均反应速率v(PCl3)=___________。
(2)该温度下,此反应的化学平衡常数的数值为___________(可用分数表示)。
(3)反应至250s时,该反应放出的热量为______________kJ。
(4)下列关于上述反应的说法中,正确的是__________(填字母序号)。
a.无论是否达平衡状态,混合气体的密度始终不变
b.300s时,升高温度,正、逆反应速率同时增大
c.350s时,向该密闭容器中充入氮气,平衡向正反应方向移动
d.相同条件下,若起始向该密闭容器中充入1.0molPCl3和0.5molCl2,达到化学平衡状态时,n(PCl5)<0.20mol
(5)温度T1时,混合气体中PCl5的体积分数随时间t变化的示意图如下。其他条件相同,请在下图中画出温度为T2(T2>T1)时,PCl5的体积分数随时间变化的曲线__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.分散质粒子的直径在1~100 nm之间的微粒称为胶体
B.电泳现象可证明胶体属于电解质溶液
C.利用丁达尔效应可以区别溶液与胶体
D.Fe(OH)3胶体带正电荷,可以产生电泳现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_______(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_______;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_______。
(3)步骤⑤是萃取、分液,某学生选择用苯来提取碘的理由是_______。在分液操作中,应充分振荡,然后静置,待分层后________(填标号),以下略。
A.直接将含碘苯溶液从分液漏斗上口倒出
B.直接将含碘苯溶液从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将含碘苯溶液从下口放出
D.先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混和气体可能含有H2、CO、CO2、HCl、NH3和水蒸气中的两种或多种,当混和气体依次通过:①少量澄清石灰水(无浑浊现象);②氢氧化钡溶液(有浑浊现象);③浓H2SO4( 无现象);④灼热氧化铜(变红);⑤无水硫酸铜(变蓝).(假设每一次吸收均完全).对该混和气体成分判断正确的是
A.一定没有CO2,肯定有H2
B.一定有CO、CO2和水蒸气
C.可能有CO2、NH3和水蒸气
D.一定有H2、CO2和HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298 K时,实验测得溶液中的反应:H2O2+2HI===2H2O+I2,在不同浓度时的化学反应速率见下表,由此可推知当c(HI)=0.500 mol·L-1,c(H2O2)=0.400 mol·L-1时的反应速率为( )
实验编号 | 1 | 2 | 3 | 4 | 5 |
c(HI)/mol·L-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
c(H2O2)/mol·L-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
v/mol·L-1·s-1 | 0.007 60 | 0.015 3 | 0.022 7 | 0.015 1 | 0.022 8 |
A. 0.152 mol·L-1·s-1 B. 0.038 0 mol·L-1·s-1
C. 0.608 mol·L-1·s-1 D. 0.760 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着各地“限牌”政策的推出,电动汽车成为汽车界的“新宠”。特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图所示。其中 A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导 Li+的高分子材料,隔膜只允特定的离子通过,电池反应式为:LixC6+Li1-xCoO2![]() C6+LiCoO2。下列说法不正确的是( )
C6+LiCoO2。下列说法不正确的是( )

A. 该隔膜只允许 Li+通过,放电时 Li+从左边流向右边
B. 放电时,正极锂的化合价未发生改变
C. 充电时 B 作阳极,该电极放电时的电极反应式为 Li1-xCoO2+xLi++xe-=LiCoO2
D. 废旧钴酸锂(LiCoO2)电池进行“放电处理”让 Li+进入石墨中而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤干馏可获得重要的化工原料,应用非常广泛。将煤焦油中的苯、甲苯与苯酚进行分离,可采取:
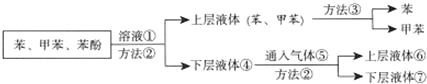
(Ⅰ)①和⑤的化学式:①_______、⑤_______。
(Ⅱ)分离方法:②_______、③_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com