
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1 |
| B.若V1=V2,反应后溶液pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
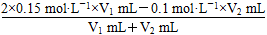 =0.1 mol·L-1,解得V1:V2=1:1。(2)①这里的HA酸有两种可能,假设它是强酸,则反应后溶液的pH=7,假设它是弱酸,则生成弱酸强碱盐,水解显碱性,pH>7,因此,混合溶液的pH大于或等于7。②若溶液pH>7,则c(Na+)>c(A-),因为c(H+)+c(Na+)=c(OH-)+c(A-),由于c(OH-)>c(H+),故有c(Na+)>c(A-)。③该条件是HA溶液中的c(H+)和NaOH溶液中的c(OH-)相等,如果两溶液混合呈中性,则c(H+)=c(OH-)=1×10-7 mol·L-1,A正确;由于HA也可能是弱酸,所以若V1=V2,反应后溶液pH可能小于7,B错误;若反应后溶液呈酸性,说明H+过量,若HA是强酸,则V1>V2;若HA是弱酸,则酸的浓度肯定大于碱的浓度,浓度越大,则体积越小,V1、V2的大小关系不易确定,可能有V1≤V2,C错误;若反应后溶液呈碱性,则碱过量,无论酸是强酸还是弱酸,碱的体积均必须大于酸的体积,D正确,故选AD。
=0.1 mol·L-1,解得V1:V2=1:1。(2)①这里的HA酸有两种可能,假设它是强酸,则反应后溶液的pH=7,假设它是弱酸,则生成弱酸强碱盐,水解显碱性,pH>7,因此,混合溶液的pH大于或等于7。②若溶液pH>7,则c(Na+)>c(A-),因为c(H+)+c(Na+)=c(OH-)+c(A-),由于c(OH-)>c(H+),故有c(Na+)>c(A-)。③该条件是HA溶液中的c(H+)和NaOH溶液中的c(OH-)相等,如果两溶液混合呈中性,则c(H+)=c(OH-)=1×10-7 mol·L-1,A正确;由于HA也可能是弱酸,所以若V1=V2,反应后溶液pH可能小于7,B错误;若反应后溶液呈酸性,说明H+过量,若HA是强酸,则V1>V2;若HA是弱酸,则酸的浓度肯定大于碱的浓度,浓度越大,则体积越小,V1、V2的大小关系不易确定,可能有V1≤V2,C错误;若反应后溶液呈碱性,则碱过量,无论酸是强酸还是弱酸,碱的体积均必须大于酸的体积,D正确,故选AD。

科目:高中化学 来源:不详 题型:单选题
 与上述混合溶液中
与上述混合溶液中 相等
相等查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.c(Na+)>2c(CO32—) |
| B.c(CO32—)>c(OH-)>c(HCO3—)>c(H2CO3) |
| C.c(OH-)=c(H+)+c(HCO3—)+2c(H2CO3) |
| D.c(CO32—)+c(HCO3—)="0.1" mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.图中对应点的温度关系为A>B |
| B.水的电离常数KW数值大小关系为B>D |
| C.温度不变,加入少量NaOH可使溶液从C点变到A点 |
| D.在B点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.H2O(g)=H2(g)+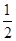 O2(g) ΔH=+242 kJ·mol-1 O2(g) ΔH=+242 kJ·mol-1 |
| B.2H2(g)+O2(g)=2H2O(l) ΔH=-484 kJ·mol-1 |
C.H2(g)+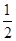 O2(g)=H2O(g) ΔH=+242 kJ·mol-1 O2(g)=H2O(g) ΔH=+242 kJ·mol-1 |
| D.2H2(g)+O2(g)=2H2O(g) ΔH=+484 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | A | B | C | D |
| 稀释前 | 酸浓度相同 | 酸浓度相同 | pH均为3 | pH均为3 |
| 稀释量 | 均为10倍 | 稀释至两酸pH相同 | 稀释至pH均为5 | 均为100倍 |
| 结论 | pH:盐酸的小 | 稀释倍数:盐酸的大 | 稀释倍数:盐酸的大 | pH:盐酸的大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.太阳能、地热能、生物质能和核聚变能均属于“新能源” |
| B.“低碳”是指采用含碳量低的烃类作为燃料 |
C.下图甲烷经一氯甲烷生成低碳烯烃的途径体现了“节能减排”思想 |
| D.让煤变成合成气,把煤“吃干榨尽”,实现了煤的清洁、高效利用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题: ,则t℃__________(填“>”、“<”或“=”)25℃。在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 a:b=______________。
,则t℃__________(填“>”、“<”或“=”)25℃。在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 a:b=______________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com