解答:
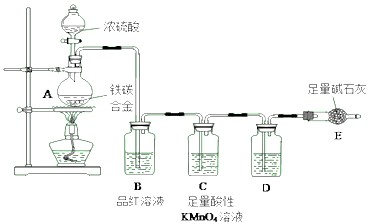
解:由装置图可知,该实验原理:通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数.故二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥.
(1)碳与浓硫酸在加热的条件下生成二氧化硫、二氧化碳、水,浓硫酸只做氧化剂,与铁加热反应浓硫酸做酸和氧化剂,所以反应方程式为C+2H
2SO
4(浓)
CO
2↑+2SO
2↑+2H
2O,
故答案为:C+2H
2SO
4(浓)
CO
2↑+2SO
2↑+2H
2O;
(2)A中生成的气体含有CO
2、2SO
2,SO
2具有漂白性,能使装置B中品红溶液褪色,说明反应中浓硫酸做氧化剂被还原为二氧化硫气体,证明具有强氧化性;C装置足量的酸性KMnO
4溶液所起的作用是为除尽反应产物中的SO
2气体,防止影响二氧化碳的质量测定,
故答案为:品红溶液逐渐褪色;强氧化性;除尽反应产物中的SO
2气体;
(3)进入干燥管前的二氧化碳需要干燥,所以D装置中是浓硫酸干燥剂,D中盛放的试剂是浓硫酸;
故答案为:浓硫酸;
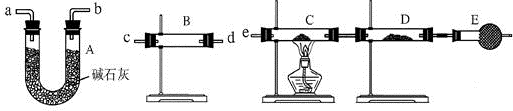
II.(1)浓硫酸具有强氧化性,Zn与浓硫酸反应生成硫酸锌、二氧化硫、水,
反应方程式为:Zn+2H
2SO
4 (浓)
ZnSO
4+SO
2↑+2H
2O,随着反应的进行浓硫酸被消耗会变成稀硫酸,锌与稀硫酸反应产生氢气,所以SO
2中的杂质可能为H
2和H
2O(g),
故答案为:氢气和水蒸气;
(2)先检验水的存在,将水除尽,再检验H
2和CuO反应生成的水,B装置检验水,A装置除去气体中的水蒸气,C、D用于检验气体中是否含有H
2,所以气流方向为:c d(或d c)a b(或b a)e,故答案为:c d(或d c)a b(或b a)e;
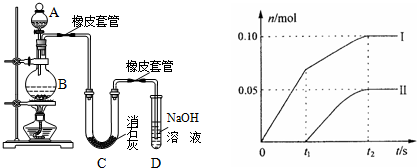
III.(1)装置中添加浓盐酸通过分液漏斗;氯气有毒,不能排放到空气中,氢氧化钠溶液的作用是吸收过量的氯气;故答案为:分液漏斗;吸收尾气;
(2)漂白粉将在U形管中产生,是氯气和氢氧化钙反应生成氯化钙、次氯酸钙、水;其化学方程式为:2Cl
2 +2Ca(OH)
2=CaCl
2 +Ca(ClO)
2 +2H
2O;
故答案为:2Cl
2 +2Ca(OH)
2=CaCl
2 +Ca(ClO)
2 +2H
2O;
(3)①温度较高时氯气与消石灰反应生成Ca(ClO
3)
2,为避免此副反应的发生,用冰水或冷水冷却;
a、当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙;当温度高时,生成氯酸钙和氯化钙,刚开始反应时,温度较低,氯气和氢氧化钙反应生成氯化钙和次氯酸钙,所以图2中曲线I表示离子ClO
-的物质的量随反应时间变化的关系;
b、根据氧化还原反应中得失电子数相等计算氯离子的物质的量,设氯离子的物质的量为n,则n×1=0.10mol×1+0.05mol×5=0.35mol,含氯元素的物质的量=0.35mol+0.1mol+0.05mol=0.5mol,氯化钙、次氯酸钙、氯酸钙中钙离子和含氯离子的个数比为1:2,所以所取石灰乳中含有Ca(OH)
2的物质的量为0.25mol;
c、取一份与②等物质的量的石灰乳,物质的量为0.25mol,根据氧化还原反应中得失电子数相等,生成氯离子得到电子和生成次氯酸根和氯酸根失去的电子守恒,设n(ClO
-)=x,n(ClO
3-)=y;则得到:①0.37=x×1+y×5;依据氯化钙、次氯酸钙、氯酸钙中钙离子和含氯元素的物质的量比为1:2,得到氯元素物质的量为0.5mol;②x+y+0.37=0.5;①②联立得到:
x=0.07mol,y=0.06mol;则n(ClO
-)/n(ClO
3-)=7:6;
故答案为:将U型管置于冷水浴中;ClO
-;0.25;7:6
②装置中无氯气的除杂装置,挥发出的氯化氢会和氢氧化钙反应,反应的化学方程式为:2HCl+Ca(OH)
2=CaCl
2+2H
2O;需要在发生装置和U型管之间放饱和氯化钠溶液,吸收氯气中的氯化氢气体;
故答案为:2HCl+Ca(OH)
2=CaCl
2+2H
2O;发生装置和U型管之间放饱和氯化钠溶液.