
【题目】常温下,在一刚性容器内部有一个不漏气且可以滑动的活塞,将容器分割成左右两室。左室充入N2,右室充入H2和O2,活塞正好使N2占容器体积的![]() (如图)。
(如图)。
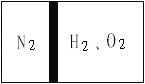
然后点燃H2和O2的混合气体,反应完毕后恢复至原来的温度,活塞正好停留在容器的中间。经检验,此时右室中气体可使带火星的木条复燃。则反应前H2和O2的物质的量之比为___。(请简要写出计算过程)
【答案】4:5
【解析】
中间活塞可动,说明左右压强相等,气体的物质的量之比等于体积之比,反应后恢复至原来的温度,活塞正好停留在容器的中间,说明反应后左右气体的物质的量相等,右室中气体可使带火星的木条复燃,说明氧气过量,利用方程式计算。
设氮气的物质的量为1mol,左室充入N2,右室充入H2和O2,活塞正好使N2占容器体积的1/4,左右压强相等,气体的物质的量之比等于体积之比,H2和O2的物质的量为3mol,点燃H2和O2的混合气体,反应方程式为2H2+O2![]() 2H2O,反应后活塞正好停留在容器的中间,反应后左右气体的物质的量相等,右室中气体可使带火星的木条复燃则剩余氧气为1mol,参加反应的H2和O2共2mol,其中n(H2)=4/3mol,n(O2)=2/3mol,原气体中n(H2)=
2H2O,反应后活塞正好停留在容器的中间,反应后左右气体的物质的量相等,右室中气体可使带火星的木条复燃则剩余氧气为1mol,参加反应的H2和O2共2mol,其中n(H2)=4/3mol,n(O2)=2/3mol,原气体中n(H2)=![]() mol,n(O2)=
mol,n(O2)=![]() mol+1mol=
mol+1mol=![]() mol,反应前H2和O2的物质的量之比为
mol,反应前H2和O2的物质的量之比为![]() :
:![]() =4:5,故答案为:4:5。
=4:5,故答案为:4:5。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】石油产品中除含有H2S外,还含有各种形态的有机硫,如COS、CH3SH。回答下列问题:
(1)CH3SH(甲硫醇)的电子式为__。
(2)一种脱硫工艺为:真空K2CO3—克劳斯法。
①K2CO3溶液吸收H2S的反应为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数的对数值为lgK=__(已知:H2CO3lgKa1=-6.4,lgKa2=-10.3;H2SlgKa1=-7,lgKa2=-19);
②已知下列热化学方程式:
a.2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H1=-1172kJ·mol-1
b.2H2S(g)+O2(g)=2S(s)+2H2O(l) △H2=-632kJ·mol-1
克劳斯法回收硫的反应为SO2和H2S气体反应生成S(s),则该反应的热化学方程式为__。
(3)Dalleska等人研究发现在强酸溶液中可用H2O2氧化COS。该脱除反应的化学方程式为__。
(4)COS水解反应为COS(g)+H2O(g)![]() CO2(g)+H2S(g) △H=-35.5kJ·mol-1,用活性α—Al2O3催化,在其它条件相同时,改变反应温度,测得COS水解转化率如图1所示;某温度时,在恒容密闭容器中投入0.3molH2O(g)和0.1molCOS(g),COS的平衡转化率如图2所示。
CO2(g)+H2S(g) △H=-35.5kJ·mol-1,用活性α—Al2O3催化,在其它条件相同时,改变反应温度,测得COS水解转化率如图1所示;某温度时,在恒容密闭容器中投入0.3molH2O(g)和0.1molCOS(g),COS的平衡转化率如图2所示。

①活性α—Al2O3催化水解过程中,随温度升高COS转化率先增大后又减小的原因可能是__,为提高COS的转化率可采取的措施是__;
②由图2可知,P点时平衡常数K=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是________________。
(2)A元素原子L层上有6个电子,B元素比A元素原子核外电子层数多1,B元素原子最外电子层只有1个电子。
①B元素的原子结构示意图________________。
②A、B两元素形成的化合物化学式是______________,该化合物与CO2反应的化学方程式是________________________。
(3)已知某粒子的结构示意图为 ,试回答:
,试回答:
①当x-y=10时,该微粒为__________(填“原子”、“阳离子”或“阴离子”)。
②当y=8时,常见的微粒可能为(填元素符称)____________、____________、____________、K+、____________。
③写出y=3与y=7的元素最高价氧化物对应水化物之间发生反应的离子方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种常见的温室气体,它的吸收和利用也成为现代科技的热门课题。
(1)恒容密闭容器中,在Cu/ZnO催化剂作用下,可用CO2制备甲醇:CO2(g) + 3H2(g)CH3OH(g) + H2O(l) △H1,已知: CH3OH(g) +![]() O2(g)=CO2(g) + 2H2O(l) △H2,写出氢气燃烧热的热化学方程式________(△H用△H1、 △H2表示)。某温度下,在体积为2L的密闭容器中加入2mol CO2、5mol H2以及催化剂进行反应生成CH3OH 蒸气和水蒸气,达到平衡时H2的转化率是60%,其平衡常数为_______。
O2(g)=CO2(g) + 2H2O(l) △H2,写出氢气燃烧热的热化学方程式________(△H用△H1、 △H2表示)。某温度下,在体积为2L的密闭容器中加入2mol CO2、5mol H2以及催化剂进行反应生成CH3OH 蒸气和水蒸气,达到平衡时H2的转化率是60%,其平衡常数为_______。
(2)工业上用CO2催化加氢制取二甲醚:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)。在两个相同的恒容密闭容器中,充入等量的反应物,分别以Ir和Ce作催化剂,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图所示:
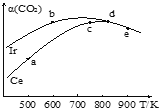
①用Ir和Ce作催化剂时,反应的活化能更低的是_________;
②a、b、c、d和e五种状态,反应一定达到平衡状态的是________,反应的ΔH ____0(填“>”、“=”或“<”);
③从状态a到c,CO2转化率不断增大的原因是__________;
④已知T℃下,将2 molCO2和6 molH2通入到体积为V L的密闭容器中进行上述反应,反应时间与容器内的总压强数据如表:
时间t/min | 0 | 10 | 20 | 30 | 40 |
总压强p/1000kPa | 1.0 | 0.83 | 0.68 | 0.60 | 0.60 |
该反应平衡时CO2的转化率为___________。
(3)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,得到NH4HCO3溶液,则反应NH4++HCO3-+H2ONH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11 )。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol/L的K2SO4溶液、0.2mol/L的Al2(SO4)3溶液和纯水混合,要使混合液中K+ 、Al3+、 SO42-的浓度分别为0.1mol/L、0.1mol/L、0.2mol/L,则所取三者的体积比是(假定混合后的体积不变)( )
A.1:1:1 B.2:1:2 C.1:1:2 D.2:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被誉为第三金属,广泛用于航空航天领域。硼化钒(VB2)—空气电池的放电反应为4VB2+11O2=4B2O3+2V2O5,以该电池为电源制备钛的装置如图所示,下列说法正确的是( )
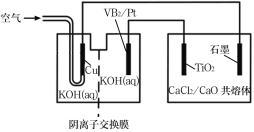
A.电解过程中,OH-由阴离子交换膜右侧向左侧迁移
B.Pt极反应式为2VB2+22OH--22e-=V2O5+2B2O3+11H2O
C.电解过程中,铜极附近电解质溶液的pH增大
D.若石墨电极上只收集到4.48L气体,则理论上制备4.8gTi
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示。则下列对该反应的推断合理的是( )
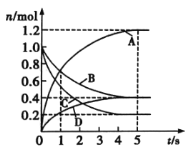
A.该反应的化学方程式为6A+2D![]() 3B+4C
3B+4C
B.0~1s内, v(A)=v(B)
C.0~5s内,B的平均反应速率为006mol·L-1·s-1
D.5s时,v(A)=v(B)=v(C)=v(D)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Z是合成某种抗结核候选药物的重要中间体,可由下列反应制得。
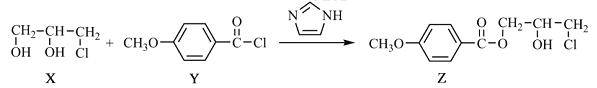
下列有关化合物X、Y和Z的说法正确的是
A.X分子中不含手性碳原子
B.Y分子中的碳原子一定处于同一平面
C.Z在浓硫酸催化下加热可发生消去反应
D.X、Z分别在过量NaOH溶液中加热,均能生成丙三醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 碳酸钡与盐酸反应2H++BaCO3===Ba2++H2O+CO2↑
B. 氢氧化钡溶液与稀硫酸混合Ba2++![]() +H++OH-===BaSO4↓+H2O
+H++OH-===BaSO4↓+H2O
C. 金属钠与水的反应 Na+H2O===Na++OH-+H2↑
D. 铜片插入硝酸银溶液中:Cu + Ag+ = Cu2+ + Ag
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com