
����Ŀ��������������Ҫ�ķ�������ij��ѧ��ȤС����̼��Ũ����Ϊ��ʼԭ�ϣ��������װ������һ��������������Ʒ�Ӧ�Ʊ��������ƣ����г�װ�ú�A�м���װ�����ԣ��������Ѽ��飩 
�������ϣ���HNO2Ϊ���ᣬ�����´��ڷ�Ӧ3HNO2�THNO3+2NO��+H2O��
��NO����Ӧ���ɱ�����KMnO4��Һ����Ϊ���ᡣ
ʵ��������ٹرյ��ɼУ���A�з�Һ©���������μ�һ����Ũ���ᣬ���ȣ�
��һ��ʱ���ֹͣ���ȡ�
(1)A�з�Ӧ�Ļ�ѧ����ʽ��_________________________________________��
(2)B�й۲쵽����Ҫ������_______________________��Dװ�õ�������___________________��
(3)ʵ�龭�Ľ�����Ƶýϴ��������ƣ����й����������Ƶ�˵����ȷ����________��
a��������������ζ���ɴ���ʳ��ʳ��
b�������£�0.1mol/L��������ҺpH=1
c��0.1mol/L����������Һ�д��ڣ�c��Na+��+c��H+��=c��NO2����+c��OH����
d��0.1mol/L����������Һ�д��ڣ�c��NO2������c��Na+����c��OH������c��H+��
���𰸡� C+4HNO3��Ũ��![]() CO2��+4NO2��+2H2O ��Һ������ͭƬ�ܽ⣬���ܿ�����ɫ����ð�� ��ȥδ��Ӧ��NO����ֹ��Ⱦ���� c
CO2��+4NO2��+2H2O ��Һ������ͭƬ�ܽ⣬���ܿ�����ɫ����ð�� ��ȥδ��Ӧ��NO����ֹ��Ⱦ���� c
�����������⿼��ʵ�鷽����������ۣ���1��A������Ũ�����ǿ�����ԣ���̼������Ӧ���䷴Ӧ����ʽΪC��4HNO3(Ũ) ![]() CO2����4NO2����2H2O����2��A�в�����NO2������Bװ�ã�����3NO2��H2O=2HNO3��NO��Cu��ϡ���ᷢ����3Cu��8HNO3=3Cu(NO3)2��2NO����4H2O���۲쵽B��������ͭƬ�ܽ⣬��Һ��Ϊ��ɫ�����ܿ�����ɫ�����������ΪNO�ж���Ϊ��ֹ��Ⱦ����������β��������������Ϣ��NO�������Ը��������Һ������Ӧ����������HNO3�����װ��D�������dz�ȥδ��Ӧ��NO����ֹ��Ⱦ��������3��a���������ξ����°��ԣ����ܴ���ʳ��ʹ�ã���a����b���������������ᣬ������0.1mol��L��1HNO2��Һ��pH>1����b����c�����ݵ���غ㣬c(Na��)��c(H��)=c(NO2��)��c(OH��)����c��ȷ��d��������������ǿ�������Σ�NO2������ˮ�⣺NO2����H2O
CO2����4NO2����2H2O����2��A�в�����NO2������Bװ�ã�����3NO2��H2O=2HNO3��NO��Cu��ϡ���ᷢ����3Cu��8HNO3=3Cu(NO3)2��2NO����4H2O���۲쵽B��������ͭƬ�ܽ⣬��Һ��Ϊ��ɫ�����ܿ�����ɫ�����������ΪNO�ж���Ϊ��ֹ��Ⱦ����������β��������������Ϣ��NO�������Ը��������Һ������Ӧ����������HNO3�����װ��D�������dz�ȥδ��Ӧ��NO����ֹ��Ⱦ��������3��a���������ξ����°��ԣ����ܴ���ʳ��ʹ�ã���a����b���������������ᣬ������0.1mol��L��1HNO2��Һ��pH>1����b����c�����ݵ���غ㣬c(Na��)��c(H��)=c(NO2��)��c(OH��)����c��ȷ��d��������������ǿ�������Σ�NO2������ˮ�⣺NO2����H2O![]() HNO2��OH������������ˮ��Һ�Լ��ԣ��������Ũ�ȴ�С˳����c(Na��)>c(NO2��)>c(OH��)>c(H��)����d����
HNO2��OH������������ˮ��Һ�Լ��ԣ��������Ũ�ȴ�С˳����c(Na��)>c(NO2��)>c(OH��)>c(H��)����d����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ϊ�ж���������Ԫ�طǽ�����ǿ����������
A.���������Ե�ǿ��B.����������Ӧ��ˮ�������Ե�ǿ��
C.�������������ϵ�����D.���ʷе�ĸߵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������и����������ʣ�
A. O2��O3 B.![]() ��
��![]() C.
C. 
D. 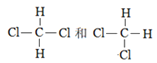 E.
E. 
��1����Ϊͬλ�ص���________������ţ���ͬ��������ͬϵ�����__________������ͬһ�����ʵ���______________����Ϊͬ���칹�����_______________��
��2��E���е��������ʵ����Ʒֱ���________________��_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��һ��ʵ���Ե�ѧ�ƣ�����������ȷ���ǣ� ��
A. ���ú������ˮ�ܲ���������������֡�����ˮ���ǽ���
B. ������顱��Ч�ɷ�Ϊ���ᣬ��Ư�ۻ��ʹ��Ч������
C. ���ý�����ұ�����õ�ⷽ��������NaCl��Һ�Ϳ��Ʊ�Na
D. ���ȷ�Ӧ�пɵõ�������ҵ�Ͽ������ø÷�Ӧ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ֲ�����è��������������������ơ��ڵ���������250������ʷ�ĺ춹ɼ����ѡ2010���������й�����ϡֲ��չ��Ʒ�֡������ں������Ļ�ѧԪ�غ�������Ļ�ѧԪ�طֱ���( )
A. C��O B. C��H C. O��C D. H��O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú��ȼ��ʱ�����SO2 �� ��ɻ�����Ⱦ������˵������ȷ���У�������
A.SO2���γ��������Ҫ����
B.�ü�Һ����ȼú�����ɼ��ٻ�����Ⱦ
C.��ˮ�ܽ⡢���˳�ȥú�еĵ������Լ���SO2�ŷ�
D.��ȼú�л�����ʯ�ң��ɼ���SO2�ŷ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������п(ZnO)��������1-100 nm֮�䣬��һ������21���͵����߹��ܾ�ϸ����Ʒ�����ֳ�������������ʡ�ij�о����Դ�����п��������CuO��FeO��MnO��Fe2O3�ȣ�Ϊԭ�ϣ�����ʪ��ѧ��(NPP-��)�Ʊ�������������п����������������ͼ��

��֪��
��pH=5.4ʱ��KMnO4�Ļ�ԭ����ΪMnO2��
������ʵ�������¸����������������pH������±���ʾ��
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Mn(OH)2 | |
��ʼ������pH | 7.5 | 2.2 | 5.2 | 6.4 | 8.6 |
������ȫ��pH | 9.0 | 3.2 | 6.7 | 8.0 | 10.1 |
����������Ϣ���ش��������⣺
��1�����չ����и�������õ��ķ��뷽����_______________________________��
��2��������1������Ҫ�ɷ���______________________________________________��
��3������Ӧ��2��������������ԭ��Ӧ�����ӷ���ʽΪ_______________________________________________________________
��4�� ����Ӧ��3���м���п�۵�������________________________________��
��5������Ӧ��4���õ��ķ�Һ�У����е���Ҫ���ӳ���Na+�⣬����______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A����ʹ��ˮ��ɫ��������̼������Һ��Ӧ�ų�CO2 �� A��CnH2n+1OH��Ӧ���ɷ���ʽΪCn+3H2n+4O2�������ش��������⣺
��1��A�ķ���ʽΪ�� �� �ṹ��ʽΪ�� ��
��2����֪��̼̼˫�����л�����±���ⷢ���ӳɷ�Ӧʱ����ԭ�����Ǽӵ�����϶��˫��̼ԭ���ϣ����˹���A��HBr�����ӳɷ�Ӧ���ɵ�����B�Ľṹ��ʽΪ�� ��
��3��B������NaOH��Һ������Ӧ����C�Ļ�ѧ����ʽ�ǣ� ��
��4��C������һ�����������ɵľۺ���Ľṹ��ʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���綯������﮵���ṩ������﮵�ؼ����Ѿ���Ϊ�����о���ǰ�ؿƼ�ij﮵�صĵ�ط�ӦΪ��xLi+Li3-xNiCoMnO6![]() Li3NiCoMnO6������˵����ȷ����
Li3NiCoMnO6������˵����ȷ����![]()
A. �õ�صij䡢�ŵ���̻�Ϊ���淴Ӧ
B. �ŵ�ʱ����صĸ�����ӦΪLi-e-=Li+
C. �ŵ�����У�Li+���صĸ����ƶ�
D. �õ�ؿ��Բ��ô��ᡢ�Ҵ�����Ϊ�������Һ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com