
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.含有1mol原子的氢气在标准状况下的体积约为22.4 L
B.25 ℃,1.01×105Pa,64 g SO2中含有的原子数为3NA
C.1 mol/L的Na2SO4溶液含Na+数为2 NA
D.标准状况下,11.2 L H2O含有的分子数为9 NA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液_______(填“显酸性”“显碱性”“显中性”或“酸碱性无法确定”),原因是_________________________________________________________。
(2)某温度下,向0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1KOH溶液至中性,此时溶液中以下关系一定正确的是__________(填字母)。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s) ![]() Ca2+(aq)+A2-(aq) ΔH>0。
Ca2+(aq)+A2-(aq) ΔH>0。
①温度升高时,Ksp_________(填“增大”“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)_________,原因是_____________________ (用文字和离子方程式说明)。
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式书写正确的是
A.硝酸铝溶液中滴加过量氨水:Al3++4NH3·H2O=AlO2-+4NH4+↑+2H2O
B.用铝粉和NaOH溶液反应制取大量H2:Al+2OH-=AlO2-+H2↑
C.实验室制取Cl2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D.氯气溶于水,与水的反应:Cl2+H2O=2H++Cl-+ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制取SO2并验证SO2的某些性质的装置,请回答:

(1)在⑥中发生反应的化学方程式为______________________________________。
(2)①中的实验现象为石蕊溶液____________,此实验证明SO2具有____________的性质。
(3)②中的品红溶液________,证明SO2有________性。
(4)③中的实验现象是________________________,证明SO2有____________性。
(5)④中的实验现象是______,证明SO2有______性。
(6)⑤的作用是____________,反应的化学方程式为____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳经济”已成为全世界科学家研究的重要课题。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)已知:①CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
②C(s)+2H2(g) ![]() CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③2CO(g) ![]() C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:____
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,在容积为2 L密闭容器中,充入1 mol CO2和3.25 mol H2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:
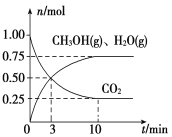
①从反应开始到平衡,氢气的平均反应速率v(H2)=________。
②下列措施一定不能使CO2的平衡转化率增大的是________。
A 在原容器中再充入1 mol CO2
B 在原容器中再充入1 mol H2
C 在原容器中充入1 mol氦气
D 使用更有效的催化剂
E 缩小容器的容积
F 将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g) ![]() H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:

①上述反应的正反应方向是________反应(填“吸热”或“放热”);
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp=_____(填表达式,不必代数计算);如果提高p(H2O)/p(CO),则Kp_______(填“变大”“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400 ℃左右、p(H2O)/p(CO)=3~5,采用此条件的原因可能是_______
(4)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4。下列关于该电池的叙述错误的是________。

A.该装置能量转化形式仅存在将太阳能转化为电能
B.铜电极为正极,电极反应式为CO2+8e-+8H+===CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用98%浓硫酸(物质的量浓度为18.4mol/L)和蒸馏水配制250mL物质的量浓度为2mol·L-1的稀硫酸。
(1)该学生需要量取上述浓硫酸____________mL(计算结果精确到0.1)。
(2)取用该浓硫酸时,下列物理量不随所取溶液体积多少而变化的是________________。
A.溶液中H2SO4的物质的量 B.溶液的密度 C.溶液的浓度
(3)稀释浓硫酸的操作是_________________。
(4)在配制过程中,下列实验操作对所配制的稀硫酸的物质的量浓度有何影响?(填偏高、偏低或无影响)
a.浓硫酸稀释后,未经冷却就立即转移到容量瓶中。________________
b.未洗涤烧杯和玻璃棒。_______________
c.定容后经振荡、摇匀、静置,发现液面下降。______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氢元素可形成种类繁多的烃类物质。
(1)下图表示某些烃分子的模型:
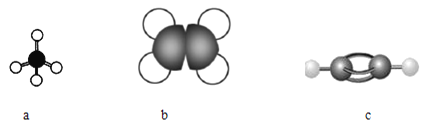
①写出a分子的空间构型______。
②c分子中的一个氢原子被![]() —取代后的物质共直线的原子最多有______个。
—取代后的物质共直线的原子最多有______个。
③取等质量的上述三种烃充分燃烧,耗氧量最大的是______(填分子式)。
④25℃和101kPa时,取a、b和c组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了56mL,原混合烃中c的体积分数为______。
(2)某烯烃的结构简式如下所示:
![]()
①用系统命名法对该烃与![]() 的加成产物命名:______,该加成产物的—氯取代物有______种。
的加成产物命名:______,该加成产物的—氯取代物有______种。
②该烯烃可以加聚生成高分子,写出该高聚物的结构简式______。该烯烃还能与乙烯以1:1比例反应形成一种环状化合物,请写出该环状化合物的键线式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第二代复合火箭推进剂发生的反应可表示为:①2NH4ClO4→N2↑+Cl2↑+2O2↑+4H2O;②4Al(s)+3O2(g)→2Al2O3(s)+QkJ(Q>0)。完成下列填空:
(1)书写H2O的电子式____________________,Cl原子核外有______种不同能量的电子。
(2)上述物质所形成的晶体中,只包含一种微粒间作用力的是________(填序号)。
a. N2 b. Al2O3 c. H2O d. NH4ClO4
(3)N2和O2都能与H2反应,但二者反应条件差异较大,分析可能原因:①从分子断键角度看,N2分子更难断键,原因是_________________________________;②从原子成键角度看,O原子更易与H原子结合,原因是______________________________________________。
(4)反应①中,氧化产物是_______;生成1molN2时,反应中转移_______NA电子。铵盐都易分解,NH4Cl、NH4HCO4等受热分解得到NH3和相应的酸,而NH4NO3等铵盐和NH4ClO4分解相似,一般无法得到对应酸,且产物可能为N2或NO等物质。请分析不同铵盐受热分解产物存在差异的可能原因:__________。
(5)下列能量变化示意图可与反应②中所体现的能量关系匹配的是________(填序号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素。下列判断正确的是( )

A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差13
D.乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com