
【题目】元素周期表是进行化学研究的重要工具,如图是元素周期表的一部分,其中①~⑨代表9种元素。请回答下列问题:
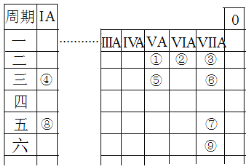
(1)上述元素中最高价氧化物对应的水化物的酸性最强的是___(填物质的化学式)。
(2)上述元素中最稳定的简单氢化物是___(填物质的化学式),请用电子式表示其形成过程:___;②④⑥形成的1:1:1型化合物的电子式为___。
(3)下列推断正确的是___(填选项字母)。
A.⑨的单质可能为白色固体
B.⑧的单质能与水剧烈反应生成氢气
C.①、⑥的简单氢化物之间反应的产物中既含离子键又含极性键
【答案】HClO4 HF ![]()
![]() BC
BC
【解析】
根据元素周期表结构及元素的位置可知,①为N,②为O,③为F,④为Na,⑤为P,⑥为Cl,⑦为I,⑧为Rb,⑨为At,再根据同周期、同主族元素性质的递变规律回答。
根据元素周期表结构及元素的位置可知,①为N,②为O,③为F,④为Na,⑤为P,⑥为Cl,⑦为I,⑧为Rb,⑨为At;
(1)因为F元素无正价,故上述元素中最高价氧化物对应的水化物的酸性最强的是HClO4,故答案为:HClO4;
(2)上述元素中,F元素的非金属性最强,故最稳定的简单氢化物是HF,电子式表示其形成过程:![]() ,②④⑥形成的1:1:1型化合物为NaClO,其电子式为:
,②④⑥形成的1:1:1型化合物为NaClO,其电子式为: ![]() ,故答案为:HF;
,故答案为:HF;![]() ;
;![]() ;
;
(3)A.⑨单质为At,卤素单质的颜色从上到下逐渐加深,故At不可能是白色固体,故A错误;
B.⑧为Rb,碱金属单质与水反应均生成H2,且活泼性从上到下逐渐增强,故Rb能与水剧烈反应生成氢气,故B正确;
C.①为N,⑥为Cl,它们的简单氢化物是NH3和HCl,两者反应生成NH4Cl,NH4Cl既含离子键又含极性键,故C正确。
故答案为:BC。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】关于电化学的下列说法正确的是
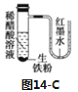
A.工业上用电解MgCl2溶液的方法冶炼Mg
B.钢铁发生吸氧腐蚀的正极反应式为4OH﹣-4e﹣═O2↑+2H2O
C.如图14-C中发生反应的方程式为:Fe+2H+=Fe2++H2↑
D.碱性锌锰干电池放电时的正极反应为: MnO2+H2O+e-=MnOOH+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 乙烯与苯都能使溴水褪色,但褪色原理不同
B. 1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气 5mol
C. 溴水遇到乙醛溶液出现褪色现象,是因为发生了氧化反应
D. ![]() 与
与![]() 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018 年 11月,国际计量大会第 26 次会议将阿伏加德罗常数的定义修改为“1摩尔包含6.02214076×1023个基本单元,单位为 mol-1。基于这一新定义,阿伏加德罗常数的不确定度被消除了。下列说法正确的是
A.10g的1H218O含有的质子数与中子数均为5×6.02214076×1023
B.100gNaHSO4和20g KHSO3的固体混合物中阳离子数为2×6.02214076×1023
C.标准状况下,2.24L Cl2溶于水,转移电子数目为6.02214076×1022
D.12g金刚石中含有化学键的数目为4×6.02214076×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,甘氨酸在水溶液中解离情况如下: 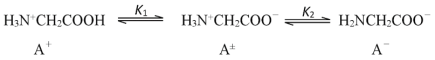 ,改变溶液pH值,三种甘氨酸相关离子的分布分数(α,平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。当调节溶液的pH值使甘氨酸所带的净电荷为零,此时溶液的pH叫等电点。下列说法正确的是
,改变溶液pH值,三种甘氨酸相关离子的分布分数(α,平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。当调节溶液的pH值使甘氨酸所带的净电荷为零,此时溶液的pH叫等电点。下列说法正确的是
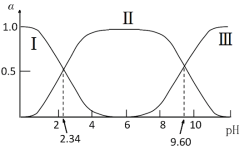
A.曲线Ⅰ、Ⅱ、Ⅲ分别代表的微粒为A-、![]() 、A+
、A+
B.K2=10-2.34,且K2对应的解离基团为—NH3+
C.在pH=9.60的溶液中加盐酸,α(![]() )+α(A+)+α(A-)保持不变
)+α(A+)+α(A-)保持不变
D.甘氨酸的等电点pH约为6,且存在c(![]() )=c(A+)=c(A-)
)=c(A+)=c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯是重要的化工原料。其实验室制备流程如下:
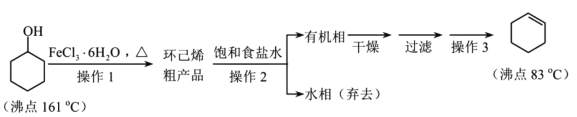
回答下列问题:
Ⅰ.环己烯的制备与提纯
(1)原料FeCl3·6H2O中若含FeCl2杂质,检验方法为:取一定量的该样品配成溶液,加入__________ (填化学式) 溶液,现象为__________。
(2)操作1的装置如图所示(加热和夹持装置已略去)。
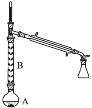
①浓硫酸也可作该反应的催化剂,选择FeCl3·6H2O而不用浓硫酸的原因为___(填序号)。
a 浓硫酸易使原料碳化并产生SO2
b FeCl3·6H2O污染小、可循环使用,符合绿色化学理念
c 同等条件下,用FeCl3·6H2O比浓硫酸的平衡转化率高
②仪器B的作用为____________。
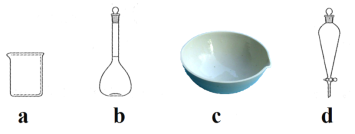
(3)下列玻璃仪器中,操作2中需使用的有________(填标号)。
(4)将操作3(蒸馏)的步骤补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,________(填序号)。
①弃去前馏分,收集83℃的馏分②加热③通冷凝水
Ⅱ.环己烯含量的测定
在一定条件下,向a g环己烯样品中加入b mol Br2。充分反应后,向所得溶液中加入足量的KI,再用c mol/L的Na2S2O3标准溶液滴定该溶液,终点时消耗Na2S2O3标准溶液v mL(以上数据均已扣除干扰因素)。 [已知:![]() ]
]
(5)滴定所用指示剂为____________。样品中环己烯的质量分数为____________(用字母表示)。
(6)上述滴定完成后,若滴定管尖嘴处留有气泡会导致最终测定的环己烯含量偏__________。(填“高”或“低”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式C8H8O2。A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱如图。关于A的下列说法中,不正确的是
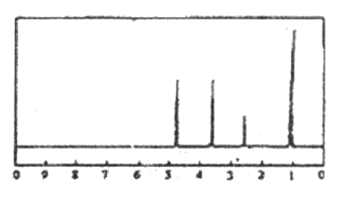
A. A分子属于酯类化合物
B. A在一定条件下可与H2发生加成反应
C. 符合题中A分子结构特征的有机物不只有一种
D. 与A属于同类化合物的同分异构体只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年中国十大科技成果之一是:我国科学家成功实现甲烷在催化剂及无氧条件下,一步高效生产乙烯、芳烃和氢气等化学品,为天然气化工开发了一条革命性技术。以甲烷为原料合成部分化工产品流程如图(部分反应条件已略去):
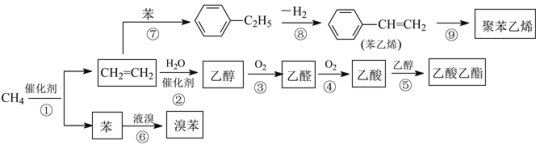
(1)乙酸分子中所含官能团名称为_____。
(2)聚苯乙烯的结构简式为_____。
(3)图中9步反应中只有两步属于取代反应,它们是_____(填序号)。
(4)写出下列反应的化学方程式(注明反应条件):
反应⑤为_____;
反应⑥为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸甲酯在NaBH4、ZnCl2等作用下可转化为醇,其中NaBH4转化为H3BO3:

(1)Zn2+基态核外电子排布式为_____。
(2)苯甲醇(![]() )中碳原子的杂化轨道类型为_____。
)中碳原子的杂化轨道类型为_____。
(3)1mol苯甲酸甲酯(![]() )分子中含有σ键的数目为_____mol。
)分子中含有σ键的数目为_____mol。
(4)与BH4﹣互为等电子体的阳离子为_____(填化学式),BH4﹣离子的空间构型为(用文字描述)_____。
(5)硼酸是一种层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图所示)。1molH3BO3晶体中有_____mol氢键。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com