
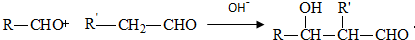 .有机物G(C20H18O4)是一种酯,合成路线如下:
.有机物G(C20H18O4)是一种酯,合成路线如下:
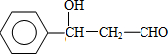 ;F的结构简式:CH2OHCH2OH;
;F的结构简式:CH2OHCH2OH; .
. 分析 由题给信息可知A为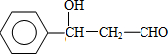 ,脱水可生成B为
,脱水可生成B为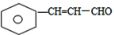 ,B与新制备氢氧化铜反应生成C为
,B与新制备氢氧化铜反应生成C为 ,由C和G可知F应为CH2OHCH2OH,则D为CH2=CH2,E为CH2BrCH2Br,结合题给信息和有机物的结构和性质解答该题.
,由C和G可知F应为CH2OHCH2OH,则D为CH2=CH2,E为CH2BrCH2Br,结合题给信息和有机物的结构和性质解答该题.
解答 解:由题给信息可知A为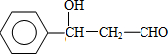 ,脱水可生成B为
,脱水可生成B为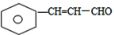 ,B与新制备氢氧化铜反应生成C为
,B与新制备氢氧化铜反应生成C为 ,由C和G可知F应为CH2OHCH2OH,则D为CH2=CH2,E为CH2BrCH2Br,
,由C和G可知F应为CH2OHCH2OH,则D为CH2=CH2,E为CH2BrCH2Br,
(1)反应①中C=O变成C-O键,应为加成反应,D为CH2=CH2,应由氯代烃发生消去反应生成,
故答案为:加成;消去;
(2)由以上分析可知A的结构简式是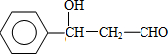 ,F为CH2OHCH2OH,
,F为CH2OHCH2OH,
故答案为: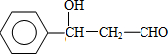 ;CH2OHCH2OH;
;CH2OHCH2OH;
(3)B为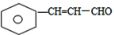 ,与新制备氢氧化铜反应生成C为
,与新制备氢氧化铜反应生成C为 ,反应的方程式为
,反应的方程式为 ,
,
故答案为: ;
;
点评 本题考查有机物的推断,题目难度较大,明确有机物的种类为解答该题的关键,注意结合题给信息结合反应流程中官能团的变化判断.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子是一种呈正四面体型的、含极性键的非极性分子 | |
| B. | 甲烷分子中两个氢原子被氯取代后,可形成两种不同结构的分子 | |
| C. | 甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业 | |
| D. | “抽”出坑道中的甲烷,既可用作清洁燃料,又可防止爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列有关其叙述不正确的是( )
下列有关其叙述不正确的是( )| A. | 该高聚物是通过加聚反应生成的 | |
| B. | 合成该高聚物的单体有三种 | |
| C. | 1mol该物质能与1molH2加成,生成不含 的物质 的物质 | |
| D. | 该高聚物能被酸性KMnO4溶液氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.00mol NaCl中含有NA个NaCl分子 | |
| B. | 1.00mol NaCl中,所有Na+的最外层电子总数为8NA | |
| C. | 欲配制1.00L,1.00mol•L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 | |
| D. | 标准状况下,11.2LCH3CH2OH中含有分子的数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氰分子中四原子共直线 | |
| B. | 氰分子中C≡N键长大于C≡C键长 | |
| C. | 氰气分子中含有σ键和π键 | |
| D. | 氰化氢在一定条件下能与烯烃发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;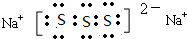 ,该化合物的水溶液在空气中久置后变质,生成一种单质和一种强碱,用化学方程式表示这一变化过程并用单线桥标记电子转移的方向和数目:
,该化合物的水溶液在空气中久置后变质,生成一种单质和一种强碱,用化学方程式表示这一变化过程并用单线桥标记电子转移的方向和数目:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3(12e-) | B. | NOx(12e-) | C. | NH3(12xe-) | D. | NOx(12xe-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
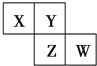 X、Y、Z、W均为短周期元素,在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍.下列说法正确的是( )
X、Y、Z、W均为短周期元素,在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍.下列说法正确的是( )| A. | X、Y、Z的原子半径大小:X>Y>Z | |
| B. | Y、Z的气态氢化物中,前者更稳定 | |
| C. | Z、W的最高价氧化物对应水化物的酸性,前者更强 | |
| D. | X、W的气态氢化物相互反应,生成物中只含离子键不含共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com