
 石油裂解产品乙烯是一种重要的化工原料,我们已学过用两种方法制得乙烯:在实验室里用乙醇与浓硫酸共热制乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计如图实验图以确认上述混合气体中有C2H4和SO2,回答下列问题:
石油裂解产品乙烯是一种重要的化工原料,我们已学过用两种方法制得乙烯:在实验室里用乙醇与浓硫酸共热制乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计如图实验图以确认上述混合气体中有C2H4和SO2,回答下列问题:| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案科目:高中化学 来源: 题型:
| A、升高温度,正反应速率增大,逆反应速率减少 | ||
| B、恒温时,压缩容器的体积,颜色加深,因平衡左移 | ||
C、达到平衡,其平衡常数为K=
| ||
| D、恒容时,升高温度,混合气体的颜色加深,该反应的焓变为正值 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 物质的制备、分离、提纯、检验是化学实验中的重要内容,利用所学知识回答下列问题:
物质的制备、分离、提纯、检验是化学实验中的重要内容,利用所学知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验 序号 | 0 | 10 | 20 | 30 | 40 | 50 | |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 950 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
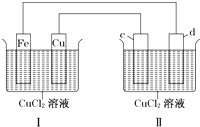 下列装置可实现电解CuCl2溶液,c、d均为石墨.读图回答下列问题:
下列装置可实现电解CuCl2溶液,c、d均为石墨.读图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、欲将蛋白质从水中析出而又不改变它的性质,应加入CuSO4溶液 |
| B、乙醇可以被氧化为乙酸,二者都能发生酯化反应 |
| C、淀粉溶液中加入一定量稀硫酸,共热一段时间后,向溶液中加入新制氢氧化铜悬浊液并加热煮沸,未见红色固体产生,证明淀粉没有发生水解 |
| D、可用NaOH溶液除去混在乙酸乙酯中的乙酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com