
【题目】下列叙述不能体现相关主旨的是
A. “水域蓝天,拒绝污染”一严控PM 2.5排放,改善雾霾天气
B. “化学,让生活更美好”一积极开发风力发电,让能源更清洁
C. “节能减排,低碳经济”一综合利用煤和石油,发展绿色化学
D. “化学,引领科技进步”一研究合成光纤技术,让通讯更快捷
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】丙烯醇(CH2= CH-CH2OH)可发生的化学反应有 ( )
①加成 ②氧化 ③燃烧 ④取代
A.只有①②B.只有①②③C.只有①③D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓度均为0.1 mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随lg V/V0的变化关系如右图所示。下列叙述正确的是
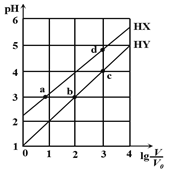
A. a、b两点的溶液中:c(X-)>c(Y-)
B. 相同温度下,电离常数K(HX):d>a
C. 溶液中水的的电离程度:d>c>b>a
D. lgV/V0=2时,若同时微热两种液体(不考虑挥发),则c(X-) /c(Y-) 增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 2.24L由氧气和臭氧组成的混合物中含有分子数目为0.1 NA
B. 1mol N2与4mol H2反应生成的NH3分子数为2NA
C. pH=1 的稀硫酸中,含有H+总数为0.1 NA
D. 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O32-+I2=2I+ S4O62-)。
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是_____________。
(2) “氧的固定”中发生反应的化学方程式为_______________。
(3)取100.00 mL水样经固氧、酸化后,用a mol·L1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为________________;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为_________mg·L1。滴定结束后如果俯视滴定管读取数据,导致测定结果偏___________。(填“高”或“低”)
(4)Na2S2O3溶液不稳定,需使用前配制和标定。预估实验需要使用75mL的Na2S2O3溶液,则配制该溶液所必需的仪器有天平、烧杯、玻璃棒和___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向密闭容器中充入物质的量浓度均为0.1 molL-1的CH4和CO2,在一定条件下发生反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
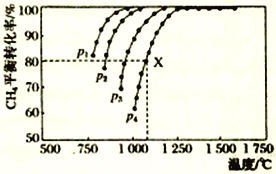
A. 随着温度升高,该反应的平衡常数减小
B. 1100℃,p4条件下,该反应10min时达到平衡点X,则v(CO2)=0.008mol·L-1·min-1
C. p1、p2、p3、p4大小的顺序为p1<p2<p3<p4
D. 平衡时CO与H2的物质的量比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,在工业上有重要的用途。
(1)已知:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) △H1;
2ClNO(g)+H2O(g)=NO(g)+2HCl(g ) △H2。
则反应:4ClNO(g)+O2(g)=2Cl2(g)+2N2O3(g)的△H=_______(用含△H1、△H2 的代数式表示 )。
(2)将NO与Cl2按物质的量之比2:1充入一绝热密闭容器中,发生反应:
2NO(g)+Cl2(g) ![]() 2ClNO(g) △H<0,实验测得NO的转化率α(NO)随时间的变化如图所示。
2ClNO(g) △H<0,实验测得NO的转化率α(NO)随时间的变化如图所示。
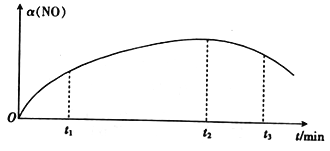
NO(g)的转化率α(NO)在t2~t3时间段内降低的原因是___________。
(3)在其他条件相同时,向五个恒温恒容的密闭容器中分别充入1mol Cl2 与2 mol NO,发生反应:2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0,部分反应条件及平衡时Cl2 的转化率如下表所示。
2ClNO(g) △H<0,部分反应条件及平衡时Cl2 的转化率如下表所示。
容器编号 | 温度/℃ | 容器体积/L | 平衡时Cl2 的转化率 |
I | T1 | 2 | 75% |
II | T2=T1 | 3 | ω2 |
Ⅲ | T3>T1 | V3 | 75 % |
Ⅳ | T4 | V4 | ω4 |
V | T5 | V5 | ω5 |
①6 min时容器I中反应达到平衡,则0~6 min内,v(NO)=______mol·L-l·min-1。
②V3______(填“ > ”“<”或“ = ”) 2。
③容器I中反应的平衡常数的值K2=______,容器Ⅲ中反应的平衡常数的值K3=_____(填“>”“<”或“=”)K2。
④容器Ⅳ、容器V分别与容器I相比只有一个实验条件不同,反应体系总压强随时间的变化如图所示。与容器I相比,容器Ⅳ改变的实验条件是_______;容器V与容器I 的体积不同,则容器V中反应达到平衡时气体总压强(P)的范围是________。
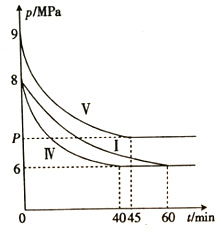
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ/mol。
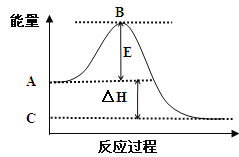 请回答下列问题:
请回答下列问题:
①图中A点表示:
C点表示:
E的大小对该反应的反应热 (填“有”或“无”)影响。
②图中△H= kJ/mol。
(2)由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得)
①写出该反应的热化学方程式:
②若1 mol水蒸气转化为液态水放热45kJ,则反应H2(g) +1/2O2(g) = H2O( l )的ΔH = kJ/mol。氢气的燃烧热为ΔH = kJ/mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com