
分析 (1)根据实验原理:氯化钠与硝酸银反应生成氯化银沉淀的质量,计算出氯化钠的质量,再用氯化钠的质量除以袋装味精样品的质量即可;
(2)根据过滤用到的仪器进行分析,
(3)取最后一次洗涤液加入氯化钠溶液看是否有沉淀生成分析判断;
(4)根据方程式AgNO3+NaCl═AgCl↓+NaNO3求出氯化钠的质量,最后求食盐的含量;
解答 解:(1)实验原理:氯化钠与硝酸银反应生成氯化银沉淀的质量,计算出氯化钠的质量,再用氯化钠的质量除以袋装味精样品的质量即可,
故答案为:②加入足量稀硝酸和硝酸银溶液.③过滤;
(2)过滤操作用到的仪器主要有漏斗(滤纸)、烧杯、玻璃棒、铁架台(铁圈);
故答案为:漏斗(滤纸)、烧杯、玻璃棒;
(3)取最后一次洗涤液加入氯化钠溶液看是否有沉淀生成分析,接取最后一次少许洗涤液,加入氯化钠溶液,若无沉淀产生,则说明已洗涤干净;
故答案为:接取最后一次少许洗涤液,加入氯化钠溶液,若无沉淀产生,则说明已洗涤干净;
(4)设:生成4.9g氯化银需要参加反应的氯化钠的质量为X则:
AgNO3+NaCl═AgCl↓+NaNO3
58.5 143.5
X 4.9g
$\frac{58.5}{X}$=$\frac{143.5}{4.9}$
解得X=2.0g;
NaCl含量为$\frac{2.0g}{10.0g}$×100%=20%,此样品是符合产品标示的质量分数,
故答案为:合格.
点评 本题考查了物质组成的分析应用,解答本题的关键是要知道所得固体质量4.9g为生成的氯化银沉淀的质量,再利用氯化银沉淀的质量通过方程式计算出氯化钠的质量,再进一步进行计算,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | c(H+)+c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| B. | 加入少量0.1mol/L的盐酸,电离平衡向左移动,c(H+)减小 | |
| C. | 加入少量NaOH固体,电离平衡向右移动,溶液导电性增强 | |
| D. | 加入少量CH3COONa固体,电离平衡不移动,溶液导电性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在c(HCO${\;}_{3}^{-}$)=0.1 mol•L-1的溶液中:NH${\;}_{4}^{+}$、Al3+、Cl-、NO${\;}_{3}^{-}$ | |
| B. | 有大量NO${\;}_{3}^{-}$存在的强酸性溶液中:NH${\;}_{4}^{+}$、Ba2+、Fe3+、Cl- | |
| C. | 由水电离出的c(H+)=1×10-12mol•L-1的溶液中:Na+、Al3+、CH3COO-、I- | |
| D. | 能使pH试纸变红的溶液中:ClO-、S2-、Na+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液出现血红色 |
| ③ | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
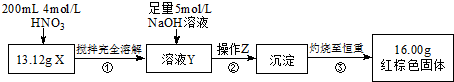
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、Cu2+、Fe3+、Al3+、Fe2+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液与稀硫酸反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | 用醋酸溶解石灰石:CaCO3+2CH3COOH═Ca2++H2O+CO2↑+2CH3COO- | |
| C. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ | |
| D. | Cu溶于稀硝酸:Cu+2H++NO3=Cu2++NO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com