100℃时,在1L恒温恒容的密闭容器中,通入0.1mol N
2O
4,发生反应:N
2O
4(g)?2NO
2(g);△H=+57.0kJ?mol
-1,NO
2和N
2O
4的浓度如图甲所示.NO
2和N
2O
4的消耗速率与其浓度的关系如乙图所示,
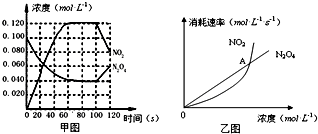
(1)在0~60s内,以N
2O
4表示的平均反应速率为
mol?L
-1?s
-1.
(2)根据甲图中有关数据,计算100℃时该反应的平衡常数:K
1═
═0.36mol?L
-1?S
-1若其他条件不变,升高温度至120℃,达到新平衡的常数是k
2,则k
1
k
2(填“>”、“<”或“=”).
(3)反应进行到100s时,若有一项条件发生变化,变化的条件可能是
.
A.降低温度 B.通入氦气使其压强增大
C.又往容器中充入N
2O
4 D.增加容器体积
(4)乙图中,交点A表示该反应的所处的状态为
.
A.平衡状态 B.朝正反应方向移动
C.朝逆反应方向移动 D.无法判断
(5)已知:
N
2(g)+2O
2(g)═2NO
2(g);△H=+67.2kJ?mol
-1.
N
2H
4(g)+O
2(g)═N
2(g)+2H
2O(g)△H=-534.7kJ?mol
-1.
N
2O
4(g)?2NO
2(g)△H=+57.0kJ?mol
-1.
则:2N
2H
4(g)+N
2O
4(g)═3N
2(g)+4H
2O(g)△H=
kJ?mol
-1.


 ?2NO2(g)△H=+57.0kJ?mol-1.
?2NO2(g)△H=+57.0kJ?mol-1.

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案 汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )
汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( ) 某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物物质,其实验装置如图.加热聚丙烯废塑料得到的产物如下表:
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物物质,其实验装置如图.加热聚丙烯废塑料得到的产物如下表: