
【题目】已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是
A.若某温度下,反应后=11,则溶液中=
B.参加反应的氯气的物质的量等于 a mol
C.改变温度,反应中转移电子的物质的量ne的范围: a mol ≤ ne ≤ a mol
D.改变温度,产物中KClO3的最大理论产量为a mol
【答案】D
【解析】
试题分析:A.令n(ClO﹣)=1mol,反应后C(Cl﹣):C(ClO﹣)=11,则n(Cl﹣)=11mol,电子转移守恒,5×n(ClO3﹣)+1×n(ClO﹣)=1×n(Cl﹣),即5×n(ClO3﹣)+1×1mol=1×11mol,解得n(ClO3﹣)=2mol,故溶液中=,故A正确;
B.由Cl原子守恒可知,2n(Cl2)=n(KCl)+n(KClO)+n(KClO3),由钾离子守恒可知n(KCl)+n(KClO)+n(KClO3)=n(KOH),故参加反应的氯气的物质的量= n(KOH)= amol,故B正确;
C.氧化产物只有KClO3时,转移电子最多,根据电子转移守恒n(KCl)=5(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n(KClO3)=n(KOH)×1/6=a mol×1/6,转移电子最大物质的量为:a mol×5×1/6=a×5/6mol,氧化产物只有KClO时,转移电子最少,根据电子转移守恒n(KCl)=n(KClO),根据钾离子守恒:n(KCl)+n(KClO)=n(KOH),故:n(KClO)=n(KOH)=a mol,转移电子最小物质的量=a mol×1=a mol,则反应中转移电子的物质的量ne的范围为:a mol≤ne≤a mol,故C正确;
D.氧化产物只有KClO3时,其物质的量最大,根据电子转移守恒n(KCl)=5(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n最大(KClO3)=![]() n(KOH)=
n(KOH)=![]() a mol,故D错误,
a mol,故D错误,
故选:D.


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 化学反应除了生成新物质外,还伴随着能量的变化
B. 对于ΔH>0的反应,反应物的总能量小于生成物的总能量
C. 放热反应都不需要加热就能发生
D. 吸热反应在一定条件(如常温、加热等)下也能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A.溴化银是一种重要的感光材料,是胶卷中的核心成分之一
B.硅晶体是一种重要的半导体材料,还可用于制造光导纤维
C.镁燃烧发出耀眼的白光,常用于制造信号弹和焰火
D.硫酸钡不容易被X射线透过,在医疗上可用作检查肠胃的内服药剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型无机材料A3M4由两种非金属元素组成,元素M位于第二周期VA族。D、E、H均为难溶于水的白色固体:化合物C、E均含A元素。其余物质均为中学化学中常见物质。
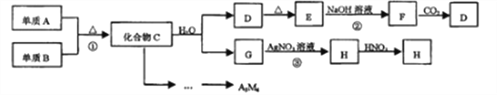
请回答:
(1)写出H的化学式:________________。
(2)化合物A3M4中含有的化学键类型为:________________。
(3)写出反应②的离子方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以环氧乙烷和布洛芬为主要原料,按下列路线合成药物布洛芬酰甘氨酸钠。
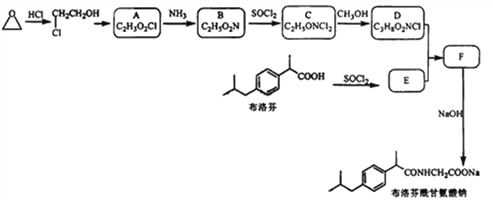
己知:(1)RCOOH ![]() RCOC1
RCOC1 ![]() RCOORˊ
RCOORˊ
(2)R-Cl- ![]() R-NH2
R-NH2 ![]() R-NH2HC1
R-NH2HC1 ![]() RCONHR
RCONHR
请回答:
(1)写出化合物的结构简式:B_________ ; D_________ 。
(2)下列说法不正确的是_________。
A.![]() 转化为A为氧化反应
转化为A为氧化反应
B. RCOOH与SOCl2反应的产物有SO2和HC1
C.化合物B能发生缩聚反应
D.布洛芬酰甘氨酸钠的分子式为C15H19NO3Na
(3)写出同时符合下列条件的布洛芬的所有同分异构体_________。
①红外光谱表明分子中含有酯基,实验发现能与NaOH溶液1∶2反应,也能发生银镜反应;
②H—NMR谱显示分子中有三个相同甲基,且苯环上只有一种化学环境的氢原子。
(4)写出F→布洛芬酰甘氨酸钠的化学方程式_________。
(5)利用题给信息,设计以![]() 为原料制备(
为原料制备(![]() )的合成路线(用流程图表示:无机试剂任选)_____________________。
)的合成路线(用流程图表示:无机试剂任选)_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁与同周期的钙性质有很大的差异,铁的熔点更高,而钙的金属活动性更强,这都说明铁的金属键比钙更_____(选填“强”、“弱”)。与钢铁比,纯净的铁有很强的抗腐蚀性,原因是_______________________。氯化铁受热会发生升华现象,这说明氯化铁是______(选填“离子”、“共价”)化合物。
(2)一定条件下,在容积一定的容器中,铁和CO2发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g),该反应的平衡常数表达式K=_____________。下列措施中能使平衡时c(CO)/c(CO2)增大的是______(选填编号)。
FeO(s)+CO(g),该反应的平衡常数表达式K=_____________。下列措施中能使平衡时c(CO)/c(CO2)增大的是______(选填编号)。
a.升高温度 b.增大压强
c.充入一定量CO d.再加入一些铁粉
(3)FeS2可在Fe2(SO4)3溶液中“溶解”,硫元素都以SO42-形式存在,请完成该反应的化学方程式。__________
____□FeS2+ □Fe2(SO4)3 +□____→ □FeSO4 +□____
(4)溶液的酸碱性对许多物质的氧化性有很大影响;生成物的溶解性会影响复分解反应的方向。将Na2S溶液滴加到FeCl3溶液中,有单质硫生成; 将FeCl3溶液滴加到Na2S溶液中,生成的是Fe2S3而不是S或Fe(OH)3。从以上反应可得出的结论是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到预期目的是
A. 检验C2H5Cl中的氯元素:将C2H5Cl和NaOH溶液混合加热后,加过量稀HNO3酸化后,再加硝酸银溶液
B. 混有乙酸、乙醇杂质的乙酸乙酯用饱和Na2CO3溶液进行除杂提纯
C. 用碘酒验证汽油是否为裂化汽油
D. 用溴水除去己烷中的己烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是
A.苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯
B.苯乙烯在合适条件下催化加氢可生成乙基环己烷
C.乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷
D.甲苯与氯气在光照下反应主要生成2,4-二氯甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷、硫、氯、砷等是农药中的重要组成元素。回答下列问题:
(1)基态砷原子的核外价电子排布式为___________。
(2)生产农药的原料PSCl3中P、S、Cl的第一电离能由大到小的顺序为_______,电负性由大到小的顺序为_______
(3)COS(羰基硫)可用作粮食的熏蒸剂,其中碳原子的杂化轨道类型为_______,所含共价键的类型为_____,写出一种与COS 键合方式相同且空间构型也相同的微粒:_______。
(4)H2O 与H2S为同族元素的氢化物,H2O可以形成H9O4+以或H3O+,而H2S几乎不能形成类似的H9S4+或H3S+,其原因是__________
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃ ,其晶胞结构如图所示。

① 磷化铝的晶体类型为________。
② A、B点的原子坐标如图所示,则C点的原子坐标为_________。
③ 磷化铝的晶胞参数a=546.35pm,其密度为________(列出计算式即可,用从表示阿伏加德罗常数的数值)g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com