
下列物质的变化过程中,化学键没有被破坏的是( )
A.食盐溶解 B.干冰升华 C.氯化铵受热 D.氯化钠熔融
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源:2013-2014湖北省黄石市秋季高二化学期中统考试卷(解析版) 题型:选择题
0.02mol·L—1的HCN溶液与0.02mol·L—1的NaCN溶液等体积混合,已知混合溶液中C(CN—)<C(Na+),则下列关系中,正确的是( )
A.C(Na+)>C(CN—)>C( H+)>C(OH―) B.C(HCN)+C (CN—)=0.04mol·L—1
C.C(Na+)+C(H+)= C(CN—)+C(OH―) D.C(CN—)>C(HCN)
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:选择题
下列有关化学用语使用正确的是
A.的结构示意图 B.中子数为20的氯原子:37 17Cl
B.中子数为20的氯原子:37 17Cl
C.明矾的化学式: KAlSO4·12H2O D.CO2的电子式: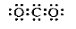
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉外国语学校高一下学期期中考试化学试卷(解析版) 题型:填空题
(12分).
在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应:
A(g) B(g)+C(g) △H=+85.1kJ·mol-1(吸热反应)
B(g)+C(g) △H=+85.1kJ·mol-1(吸热反应)
反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为_______________。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为_______。平衡时A 的转化率为_____.
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),
n总=_______mol,n(A)=_______mol。
②下表为反应物A浓度与反应时间的数据,计算a= _______________
反应时间t/h | 0 | 4 | 8 | 16 |
C(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.0065 |
分析该反应中反应物的浓度c(A)变化与时间间隔(△t)的规律,得出的结论是_________________,由此规律推出反应在12h时反应物的浓度c(A)为_______mol·L-1
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉外国语学校高一下学期期中考试化学试卷(解析版) 题型:选择题
已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是
A.这四种离子的电子层结构相同,因而离子的性质也就相同
B.原子序数:b>a>c>d
C.最高价氧化物对应水化物的碱性:B>A
D.气态氢化物的稳定性:D>C
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉外国语学校高一下学期期中考试化学试卷(解析版) 题型:选择题
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法正确的是

A.W的原子序数可能是Y的原子序数的2倍
B.Z元素的原子半径可能比Y元素的小
C.W的气态氢化物的稳定性一定比Y的强
D.若Z的最高正价为+m,则X的最高正价也一定为+m
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省宜昌市高三5月模拟理综化学试卷(解析版) 题型:实验题
(14分)金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如下:

已知:2H2SO4(浓)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O
(1)步骤I中发生反应的离子方程式: 、 。
(2)已知:TiO2+易水解,只能存在于强酸性溶液中。
25 ℃时,难溶电解质溶解度与pH关系如图,

TiO(OH)2溶度积Ksp=1×10-29
①步骤Ⅲ加入铁屑原因 是 。
② TiO2+水解的离子方程式为 。
向溶液II中加入Na2CO3粉末的作用是 。
当溶液pH= 时,TiO(OH)2已沉淀完全。
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| TiCl4 | Mg | MgCl2 | Ti |
熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(4)电解TiO2制备钛的方法如图所示。该方法由于具备生产过程简化、生产成本低、产品质量高、环境友好等诸多优点而引人注目。已知TiO2熔融状态下不发生电离,电解时阴极反应式为 。

查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省大冶市春季期末考试高二化学试卷(解析版) 题型:选择题
已知:2CO(g)+O2(g)=2CO2(g) ΔH= -566 kJ?mol-1
Na2O2(s)+CO2(g) = Na2CO3(s)+1/2O2(g) ΔH= -226 kJ?mol-1
下列表述正确的是(NA代表阿伏伽德罗常数的数值) ( )
A.1molCO燃烧时放出的热量为283 kJ?mol-1
B.Na2O2(s)+CO(g) = Na2CO3(s) ΔH= -509 kJ?mol-1
C.Na2O2(s)与CO2(g)反应放出226 kJ热量时电子转移数为2NA
D.Na2O2和Na2CO3中阴阳离子个数比不同
查看答案和解析>>
科目:高中化学 来源:2013-2014海口市第二学期高二化学期中考试(B卷)试卷(解析版) 题型:选择题
下图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )

A.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸
B.试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象
C.实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使反应向生成乙酸乙酯的方向移动
D.试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com