
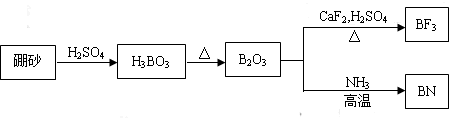
分析 本题是以天然硼砂为起始物,经过一系列反应得BF3和BN的工业流程,涉及用化学方程式表示反应原理及BN中按元素非金属性的强弱及在元素周期表中的位置确定元素化合价,另外以冰晶石的制备原理,探究元素非金属性强弱比较、纯碱的分类及侯氏制碱法的原料等,据此可作答;
Ⅰ(1)由图可知B2O3与CaF2和H2SO4反应即生成BF3,同时还应该产生硫酸钙和水,结合原子个数守恒写出方程式;
(2)B的非金属性氮弱,B第ⅢA族元素;
Ⅱ(3)根据反应物中的元素可知,氧、氟元素位置相邻,则利用非金属性强弱的判断方法来解答;
(4)根据物质的构成微粒来分析晶体类型,根据侯氏制碱法来分析工业制取纯碱的原料;
(5)二氧化碳是非极性分子,由碳最外层4个电子,氧最外层6个电子,则二氧化碳的电子式为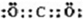 ,据此再写出CO2的结构式.
,据此再写出CO2的结构式.
解答 解:Ⅰ(1)由工艺流程可知,B2O3与NH3反应生成BN,根据原子守恒可知,还有水生成,反应方程式为:B2O3+3CaF2+3H2SO4$\frac{\underline{\;加热\;}}{\;}$2BF3↑+3CaSO4+3H2O;B2O3+2NH3$\frac{\underline{\;加热\;}}{\;}$2BN+3H2O,故答案为:B2O3+3CaF2+3H2SO4$\frac{\underline{\;加热\;}}{\;}$2BF3↑+3CaSO4+3H2O;B2O3+2NH3$\frac{\underline{\;加热\;}}{\;}$2BN+3H2O;
(2)B的非金属性比N弱,在BN中显正价,B第ⅢA族元素,故为+3价,故答案为:+3;
Ⅱ(3)该反应中的物质含有的元素有Al、O、H、F、Na、C,只有O、F元素相邻,因F的非金属性最强,则没有正价,也就没有最高价氧化物对应水化物,它们也不与酸反应,但可以利用气态氢化物的稳定性和单质与氢气反应的难易来判断O、F非金属性的强弱,故答案为:ac;
(4)因碳酸钠的构成微粒为钠离子和碳酸根离子,则碳酸钠的固体属于离子晶体,工业制纯碱是用氯化钠、二氧化碳和氨气反应,则原料为氯化钠、二氧化碳和氨气,故答案为:离子;氯化钠、二氧化碳和氨气;
(5)由CO2的电子可知,C与O之间存在C=O键,其结构式为O=C=O,故答案为:O=C=O.
点评 本题考查元素周期表的位、构、性之间的关系,属基础性知识,难度较低,建议重视基础知识的复习,夯实基础才是答题之本.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 草酸亚铁可用于合成锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)等,其制备过程主要包括:
草酸亚铁可用于合成锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)等,其制备过程主要包括:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,反应类型:属于取代反应;
,反应类型:属于取代反应; ,反应类型:属于加成反应.
,反应类型:属于加成反应.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | |||
| C | D | |||
 ,其分子中共含有10个电子,A和D形成的常见化合物是由极性(填“极性”、“非极性”)键形成的.
,其分子中共含有10个电子,A和D形成的常见化合物是由极性(填“极性”、“非极性”)键形成的.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com