
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1NaOH溶液恰好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常温下,将0.1 mol•L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的10倍 | |
| D. | 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol•L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) |
分析 A.常温下,0.1 mol•L-1Na2S溶液中存在质子守恒,水电离出的氢氧根离子和所有氢离子存在形式综合相同;
B.温下,0.1 mol•L-1HA溶液与0.1 mol•L-1NaOH溶液恰好完全反应时生成NaA溶液,溶液酸碱性取决于HA酸的强弱;
C.常温下,将0.1 mol•L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,氢离子浓度缩小为原来的$\frac{1}{10}$倍,$\frac{c(CH3COO-)}{c(CH3COOH)}$=$\frac{Ka}{c({H}^{+})}$;
D.常温下pH=7的溶液为中性溶液,则c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-).
解答 解:A.根据质子守恒,有c(OH-)=c(H+)+c(HS-)+2c(H2S),故A错误;
B.c(OH-)=c(H+),说明溶液呈中性,因为HA的酸性的强弱未知,所以与氢氧化钠恰好完全反应得到的NaA溶液不一定是中性溶液,可能是碱性溶液,故B错误;
C.常温下,将0.1 mol•L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,氢离子浓度缩小为原来的$\frac{1}{10}$倍,$\frac{c(CH3COO-)}{c(CH3COOH)}$=$\frac{Ka}{c({H}^{+})}$,醋酸的电离常数不变,氢离子浓度缩小10倍,则比值增大到原来的10倍,故C正确;
D.根据电荷守恒,常温下pH=7的溶液为中性溶液,则c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-),故D错误,
故选C.
点评 本题考查了电解质溶液中离子浓度大小比较,质子守恒的分析、弱电解质溶液中电离平衡的影响因素判断,注意水解和弱电解质电离的理解应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
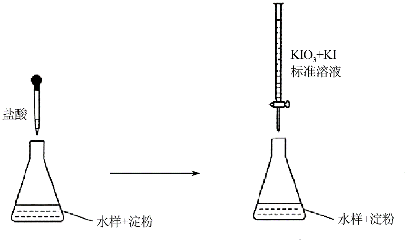
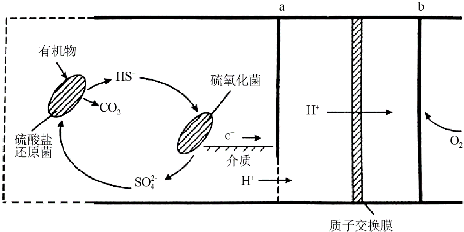
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤是无机化合物,天然气和石油是有机化合物 | |
| B. | 利用化石燃料燃烧放出的热量使分解产生氢气,是氢能开发的研究方向 | |
| C. | 化学电源放电、植物光合作用都能发生化学变化,并伴随能量的转化 | |
| D. | 若化学过程中断开化学键放出的能量大于形成化学键所吸收的能量,则反应放热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
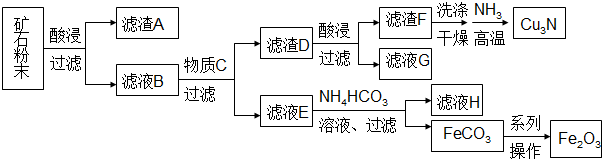
| A. | 每生成1mol Cu3N,转移的电子为6mol | |
| B. | 滤液G可以并入滤液E加以利用 | |
| C. | 加入NH4HCO3溶液需控制温度以抑制Fe2+水解和NH4HCO3分解 | |
| D. | 由FeCO3转化为Fe2O3的操作包括洗涤、干燥、空气中煅烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
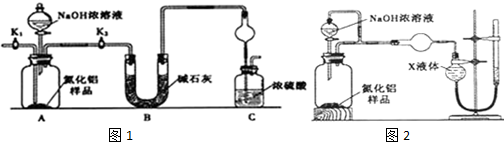
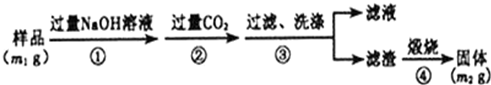
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 操作 | |
| A | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入酸性KMnO4溶液 |
| B | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| C | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| D | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上生产玻璃、水泥、漂白粉均需要用石灰石为原料 | |
| B. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 | |
| C. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| D. | 司母戊鼎、定远舰甲板、有机玻璃等原材料属于合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
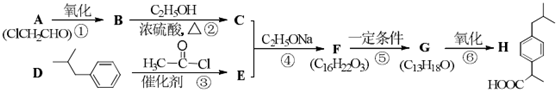
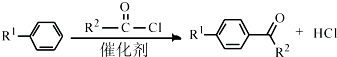 (R1、R2代表烷基)
(R1、R2代表烷基)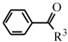 +ClCH2COOR4+R4ONa→
+ClCH2COOR4+R4ONa→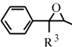 COOR4+R4OH+NaCl(R3、R4代表烷基)
COOR4+R4OH+NaCl(R3、R4代表烷基)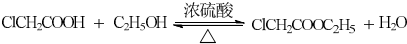 .
. .
.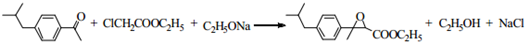 .
.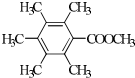 、
、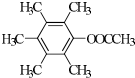 、
、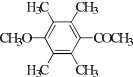 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com