
| A. | 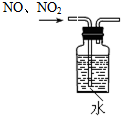 除去NO中的NO2 | B. | 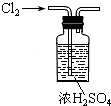 干燥Cl2 | C. | 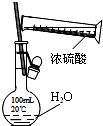 稀释浓硫酸 | D. |  制备少量O2 |
分析 A.二氧化氮与水反应生成NO,但装置内部有空气;
B.干燥时气体长进短出,浓硫酸与氯气不反应;
C.不能在容量瓶中稀释;
D.过氧化钠为粉末状固体,关闭活塞不能控制反应的停止.
解答 解:A.二氧化氮与水反应生成NO,但装置内部有空气,应将试剂瓶充满水,故A错误;
B.干燥时气体长进短出,浓硫酸与氯气不反应,浓硫酸具有吸水性,则该装置可干燥氯气,故B正确;
C.不能在容量瓶中稀释,应在烧杯中稀释、冷却后转移到容量瓶中,故C错误;
D.过氧化钠为粉末状固体,关闭活塞不能控制反应的停止,则该装置不能制备少量氧气,故D错误;
故选B.
点评 本题考查化学实验方案的评价及实验装置综合应用,为高频考点,把握物质的性质、实验技能、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:选择题
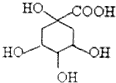 奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中不正确的是( )
奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中不正确的是( )| A. | 不能使溴的四氯化碳溶液褪色 | |
| B. | 能用碳酸氢钠溶液鉴别奎尼酸和苯 | |
| C. | 1 mol奎尼酸与足量钠反应生成56L氢气 | |
| D. | 与乙醇、乙酸均能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6 g | B. | 2.4 g | C. | 3.2 g | D. | 4.8 g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
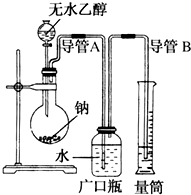 为了确定乙醇分子的结构简式是CH3-O-CH3还是CH3CH2OH,实验室利用右图所示的实验装置,测定乙醇与钠反应(△H<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子数目.试回答下列问题:
为了确定乙醇分子的结构简式是CH3-O-CH3还是CH3CH2OH,实验室利用右图所示的实验装置,测定乙醇与钠反应(△H<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子数目.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Al3+、Mg2+、SO32- | B. | K+、CO32-、I- | C. | Al3+、CO32-、I- | D. | Na+、Br-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| B. | 葡萄糖注射液不能产生丁达尔效应,不属于胶体 | |
| C. | 蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质 | |
| D. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,与肺癌等疾病的发生无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
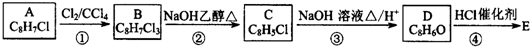
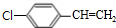 ,B中含有的官能团是氯原子.
,B中含有的官能团是氯原子.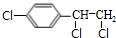 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$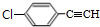 +2NaCl+2H2O,其反应类型为消去反应.
+2NaCl+2H2O,其反应类型为消去反应.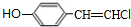 ;
;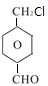 、
、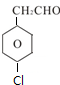 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 1×l05 Pa | 5×l05 Pa | 10×l05 Pa | 50×l05 Pa | 100×l05 Pa | |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 500℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com