
| A. | 升高温度 | B. | 减压 | C. | 加压 | D. | 适当降温 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol 乙酸(忽略挥发损失)与足量的C2H5${\;}_{\;}^{18}$OH在浓硫酸作用下加热,充分反应可生成NA个CH3CO${\;}_{\;}^{18}$OC2H5分子 | |
| B. | 常温常压下,7.8gNa2O2含离子数为 0.4NA | |
| C. | 标准状况下,11.2LCCl4 中含分子数为 0.5NA | |
| D. | 6.4gO2和O3 的混合气体,含氧原子数为 0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用丁达尔现象区分溶液与胶体 | |
| B. | 用蒸馏的方法除去自来水中含有的Cl- | |
| C. | 用萃取的方法从某些植物中提取香料或中药成份 | |
| D. | 金属钠长期暴露在空气中的最终产物是NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molCl2常温下与过量NaOH溶液反应转移电子总数为 0.1NA | |
| B. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 0.25 mol Na2O2中含有的阴离子数为0.5 NA | |
| D. | 1L 0.1mol•L-1的硫化钠溶液中硫离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
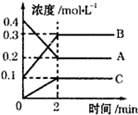 (1)甲醇(CH3OH)是一种重要的化工原料.已知 CH3OH(1)+O2(g)=CO(g)+2H2O(g);△H=-443.64kJ•mol-1
(1)甲醇(CH3OH)是一种重要的化工原料.已知 CH3OH(1)+O2(g)=CO(g)+2H2O(g);△H=-443.64kJ•mol-1 2B+C.
2B+C.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
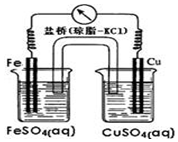
| A. | 铜作正极,发生氧化反应 | |
| B. | 外电路中电流方向为Fe→Cu | |
| C. | Fe电极的电极反应式为Fe-3e-=Fe3+ | |
| D. | 盐桥将两电解质溶液连接起来,传导电流,通过等量的K+和Cl-的定向移动,使两电解质溶液保持电中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com