
四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
| 元素 | T | X | Y | Z |
| 性质 结构 信息 | 人体内含量最多的元素,且其单质是常见的助燃剂。 | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼。 | 单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 | 第三周期元素的简单离子中半径最小 |
(1)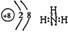 >
>
(2)1S22S22P63S23P1
(3)Al(OH)3 Al3+ + 3OH- 、Al(OH)3
Al3+ + 3OH- 、Al(OH)3 AlO2- + H+ + H2O
AlO2- + H+ + H2O
(4)F bc
解析试题分析:
(1)T元素人体内含量最多,且单质是常见的助燃剂,故T为氧元素。X单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼。故X为氮元素。Y但在在空气中燃烧发出黄色的火焰,Y为钠元素。Z为第三周期元素的简单离子中半径最小,故Z为铝元素。Y、Z简单离子电子层结构相同,故原子序数越大,离子反应越小,故Y离子>Z离子。
(2)Z为铝元素,故核外电子排布为1S22S22P63S23P1
(3)Al的最高价氧化物对应的水化物为Al(OH)3,其电离分为酸式电离,Al(OH)3 AlO2- + H+ + H2O;碱式电离,Al(OH)3
AlO2- + H+ + H2O;碱式电离,Al(OH)3 Al3+ + 3OH-。
Al3+ + 3OH-。
(4)T元素为氧元素,元素周期表中,非金属性最强的元素为F,故非金属性O<F。a,二者都为分子晶体,单子颜色的深浅主要由相对分子质量大小控制。b,氟气与T的氢化物剧烈反应,产生T的单质,证明,F能够将T的氢化物中置换出来,证明F的非金属性较强。c,氟与T形成的化合物中T元素呈正价态,证明F得电子能力大于T,故F的非金属性较强。d,两元素的单质与氢气化合时的难易程度,或得到氢化物的稳定程度可比较非金属性强弱,与得电子数目无关,故选择bc。
考点:原子结构、元素周期律、非金属性强弱判断。


科目:高中化学 来源: 题型:填空题
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。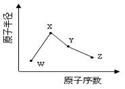
(1)X位于元素周期表中的位置 ;18W与X形成原子个数1:1的物质,该物质与H2O反应的化学方程式 。(在化学式中标出质量数18)
(2)X的单质和Y的单质相比,熔点较高的是_____(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是_______(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
四种短周期元素A、B、C、D,原子序数依次增大,结合下列信息:
(1)A的最高价氧化物对应的水化物E与其气态氢化物F反应,得到离子化合物G。
(2)B的焰色应呈黄色。
(3)C在同周期主族元素形成的简单离子中,离子半径最小.
(4)D最高正价与最低负价之和为零.
回答下列问题:
(1)写出D在元素周期表中的位置:
(2)写出化合物F的电子式 ,结构式
(3)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是 (填元素符号)
(4)下列可作为比较元素B和C金属性强弱的依据是 ( 填序号)
a.自然界中的含量b.相应氯化物水溶液的pH
c.单质与水反应的难易程度 d.单质与酸反应时失去的电子数
A的一种氢化物HA3可用于有机合成,其酸性与醋酸相似,体积和浓度均相等的HA3与B的最高价 氧化物对应的水化物的溶液混合,反应的化学方程式是 混合后溶液中离子浓度由大到小的顺序是
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有A、B、C、D、E、五种常见的短周期元素,它们的原子序数依次增大,其中C元素原子最外层电子数是次外层电子数的3倍,B元素原子的最外层电子数比C元素原子的最外层电子数少1个;A和D,C和E同主族,又知C、E两原子序数之和是A、D两原子序数之和的2倍。请回答下列问题:
(1)写出由A、C、D三种元素形成的化合物的电子式 ,该化合物的化学键类型为 。
(2)D2E溶液呈 (填“碱性”、“酸性”、“中性”),试用离子方程式解释原因 。
(3)0.5 L 0.1mol·L—1D的最高价氧化物的水化物与0.25L 0.1 mol·L—1E的最高价氧化物的水化物反应放出2865J的热量,该反应的热化学方程式为: 。
(4)由B的氢化物与C的单质、KOH溶液构成原电池,负极产生B的单质。则其负极电极反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
| | W | X | Y | Z |
| 结构或性质 | 最高价氧化物是温室气体,其原子的最外层电子数是次外层电子数的2倍 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 氧化物是常见的两性化合物 | 最高正价与最低负价之和为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D是原子序数依次增大的短周期主族元素,A、C在元素周期表中的相对位置如图,A元素最外层与次外层上的电子数之差为3,B为地壳中含最最多的金属元素。
| A | |
| | C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期主族元素X、Y、Z、W、Q的原子序数依次增大。X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z、W是常见金属,Z的氧化物可做耐火材料,W的简单离子是同周期中离子半径最小的,Q的p能级上有一个未成对电子。试回答下列问题:
(1)比较第一电离能:Z W(填“>”、“<”或“=”,后同);电负性:X Y。
(2)写出Q的价电子排布图 ,YF3的结构式 。
(3)向硫酸铜溶液中逐滴滴入Y的氢化物的水溶液至过量,用离子方程式表示该过程出现的现象变化:
_________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧族元素的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含氧族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1) S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是 。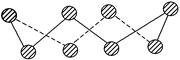
(2)Se原子在元素周期表中位置为 ;
其基态原子核外价电子的轨道表示式为 。
(3)气态SeO3分子的立体构型为 。
(4)H+可与H2O形成H3O+,H3O+中存在的共价键类型为: 。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为_____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
三氟化氮是一种无色、无味、无毒且不可燃的气体、在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF3是一种三角锥形分子,键角102°,沸点-l29℃;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备NF3的化学反应方程式: 。
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是 。
(3)与铜属于同一周期,且未成对电子数最多的元素基态原子核外电子排布式为 。
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用。该物质为配合物,其中心离子是 ,配位数为 。
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com