
c(N
| ||
| c(NH3?H2O) |
c(N
| ||
| c(NH3?H2O) |
c(N
| ||
| c(NH3?H2O) |


科目:高中化学 来源: 题型:

| A、M与A均能使酸性高锰酸钾溶液和溴水褪色 |
| B、B中含有羧基和羟基两种官能团,能发生消去反应和酯化反应 |
| C、A、B、C各1mol分别与金属钠反应,放出气体的物质的量之比为1:2:2 |
| D、1molM与热的烧碱溶液反应,可消耗2nmolNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
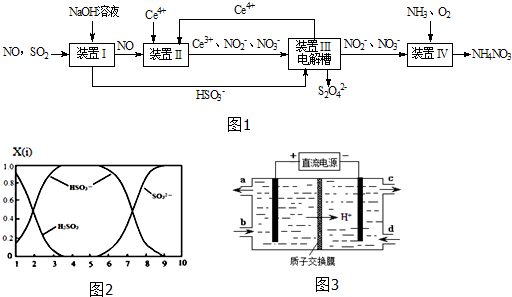
查看答案和解析>>
科目:高中化学 来源: 题型:
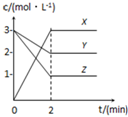 如图表示800℃时,X、Y、Z三种气体物质的浓度随时间变化的情况.试回答:
如图表示800℃时,X、Y、Z三种气体物质的浓度随时间变化的情况.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中溶液全部加热蒸干 |
| B、蒸馏操作时,应将温度计水银球置于蒸馏烧瓶的支管口附近 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、使用容量瓶和分液漏斗前,要先检查是否漏水后使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com