
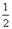 O2(g) △H1 =" +242" kJ·mol-1
O2(g) △H1 =" +242" kJ·mol-1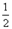 O2(g)="MgO(s) " △H3 = -602kJ·mol-1
O2(g)="MgO(s) " △H3 = -602kJ·mol-1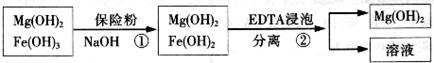
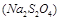 的作用: 。
的作用: 。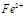 反应生成易溶于水的物质,不与
反应生成易溶于水的物质,不与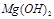 反应。虽然
反应。虽然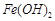 难溶于水,但步骤②中随着EDTA的加入,最终能够将
难溶于水,但步骤②中随着EDTA的加入,最终能够将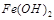 除去并获得纯度高的
除去并获得纯度高的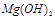 。请从沉淀溶解平衡的角度加以解释 ;
。请从沉淀溶解平衡的角度加以解释 ;| 精制阻燃剂的条件 | 阻燃剂铁含量 | |||
| 序号 | 提纯体系温度/℃ | 加入EDTA质量/g | 加入保险粉质量/g | W(Fe)/(10-4g) |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g)+H2(g) ΔH=+131.3 kJ?mol-1,
CO(g)+H2(g) ΔH=+131.3 kJ?mol-1, H2(g)+CO2(g),某温度下该反应的平衡常数K= 4/9。该温度下在甲、乙、丙三个恒容密闭容器中,只投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是 。
H2(g)+CO2(g),某温度下该反应的平衡常数K= 4/9。该温度下在甲、乙、丙三个恒容密闭容器中,只投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是 。| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
 CH3OH(g)+H2O(g) ,右图表示该反应进行过程中能量(单位为kJ?mol—1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2反应
CH3OH(g)+H2O(g) ,右图表示该反应进行过程中能量(单位为kJ?mol—1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2反应
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.4Q1+0.15Q2 | B.0.2Q1+0.05Q2 |
| C.0.2Q1+0.15Q2 | D.0.2Q1+0.3Q2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Ni(CO)4(g),该反应的△H______0 (选填“>”或“=”或“<”)。
Ni(CO)4(g),该反应的△H______0 (选填“>”或“=”或“<”)。 与温度(t)的关系曲线图。则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K=______________。800℃时,其中最易被还原的金属氧化物是___________,该反应的平衡常数数值(K)等于__________。
与温度(t)的关系曲线图。则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K=______________。800℃时,其中最易被还原的金属氧化物是___________,该反应的平衡常数数值(K)等于__________。
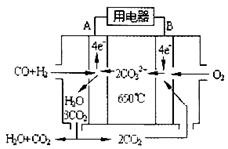
 CH3OH(g) △H=-90.7 kJ·mol-1
CH3OH(g) △H=-90.7 kJ·mol-1 CH3OCH3(g)+H2O(g) △H=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H=-23.5 kJ·mol-1 CO2(g)+H2(g) △H=-41.2 kJ·mol-1
CO2(g)+H2(g) △H=-41.2 kJ·mol-1 CH3OCH3(g)+CO2(g)的△H=_______________。
CH3OCH3(g)+CO2(g)的△H=_______________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在相同的条件下,2mol 氢气与 1 mol 氧气的总能量小于2mol 水蒸气的总能量 |
| B.H2(g)+1/2 O2(g)→H2O(1)+Q1;Q1>241.8kJ |
| C.H2(g)+ 1/2O2(g)→H2O(1)+Q2;Q2<241.8kJ |
| D.任何条件下,2L水蒸气分解成2L氢气与1L氧气需吸收483.6kJ热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
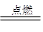 2H2O,试回答下列问题。
2H2O,试回答下列问题。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
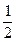 O2(g)====H2O(l)△H=-285kJ·mol-1
O2(g)====H2O(l)△H=-285kJ·mol-1 )+5O2(g)====3CO2(g)+4H2O(l)△H=-2220.0kJ·mol-1
)+5O2(g)====3CO2(g)+4H2O(l)△H=-2220.0kJ·mol-1 )====H2O(g) △H=+44.0kJ·mol-1,写出丙烷燃烧生成CO2和气态水的热化学方程式_________________________________________。
)====H2O(g) △H=+44.0kJ·mol-1,写出丙烷燃烧生成CO2和气态水的热化学方程式_________________________________________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com