
TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业。工业上利用TiO2制备金属钛的流程如下。
已知:I.
Ti(s)+O2(g)=TiO2(s) △H=-946 kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1
Ti(s)+2Cl2(g)=TiCl4(g) △H=-815 kJ·mol-1
II.某温度下各物质的沸点如下:
| 物质 | TiCl4 | FeCl3 | SiCl4 | AlCl3 |
| 沸点/℃ | 136 | 310 | 56.5 | 180 |
 TiCl4(g)+2CO (g) 。试计算其反应的△H= kJ?mol-1;反应的平衡常数表达式K= ,在下图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。
TiCl4(g)+2CO (g) 。试计算其反应的△H= kJ?mol-1;反应的平衡常数表达式K= ,在下图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。
 TiCl4(l)+O2(g)△H=+151kJ?mol-1。该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因
TiCl4(l)+O2(g)△H=+151kJ?mol-1。该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因 (16分)
(1)—90 (2分);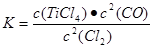 (平衡常数2分,作图2分,共4分)
(平衡常数2分,作图2分,共4分)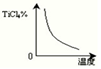
(2)蒸馏(分馏) (2分)
(3)降低生成物O2浓度,平衡向正方向移动 (或者碳与氧气反应放热,升高温度,导致平衡向吸热反应方向或正反应方向移动,3分)
(4)防止高温下Na(Ti)与空气中的O2(或CO2)作用(2分)
(5)TiO2+4e-=Ti+2O2- (3分)
解析试题分析:(1)先将已知热化学方程式编号为①②③,观察发现③—①+②可以约去Ti(s)、O2(g),根据盖斯定律,可以得到热化学方程式:TiO2(s)+2Cl2(g)+2C(s) TiCl4(g)+2CO (g) △H=-90 kJ·mol-1;根据平衡常数定义可知,
TiCl4(g)+2CO (g) △H=-90 kJ·mol-1;根据平衡常数定义可知,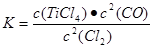 ;由于正反应的△H=-90 kJ·mol-1,正反应是放热反应,升高温度,平衡向吸热反应方向或逆反应方向移动,则TiCl4的百分含量逐渐减小,即随着温度的升高,TiCl4的百分含量逐渐减小;(2)读表中信息,TiCl4的沸点与杂质相差较大,因此可以利用沸点差异大的性质,选择蒸馏或分馏进行分离提纯;(3)从外界条件对化学平衡移动的角度分析,加入碳后,碳能与氧气反应生成二氧化碳,即C(s)+O2(g)=CO2(g),减小氧气浓度,使平衡向正反应方向移动;同时碳与氧气反应放出热量,使体系温度升高,由于正反应是吸热反应,则升温平衡向正反应方向移动;(4)还原工序中加入的钠是强氧化剂,容易被空气中氧气或水、二氧化碳等物质氧化,在惰性气体氛围中能防止高温下Na(Ti)与空气中的O2(或CO2)作用,提高钛的产率;(5)根据电解原理,阴极的主要反应物和产物分别是二氧化钛和单质钛,即TiO2→Ti;由于钛元素由+4价降为0价,得到4个电子,则TiO2+4e—→Ti;由于内电路中熔融电解质中氧离子可以传导,因此用氧离子使左右电荷守恒,即TiO2+4e—→Ti+2O2—;所以,阴极反应式为TiO2+4e-=Ti+2O2-。
;由于正反应的△H=-90 kJ·mol-1,正反应是放热反应,升高温度,平衡向吸热反应方向或逆反应方向移动,则TiCl4的百分含量逐渐减小,即随着温度的升高,TiCl4的百分含量逐渐减小;(2)读表中信息,TiCl4的沸点与杂质相差较大,因此可以利用沸点差异大的性质,选择蒸馏或分馏进行分离提纯;(3)从外界条件对化学平衡移动的角度分析,加入碳后,碳能与氧气反应生成二氧化碳,即C(s)+O2(g)=CO2(g),减小氧气浓度,使平衡向正反应方向移动;同时碳与氧气反应放出热量,使体系温度升高,由于正反应是吸热反应,则升温平衡向正反应方向移动;(4)还原工序中加入的钠是强氧化剂,容易被空气中氧气或水、二氧化碳等物质氧化,在惰性气体氛围中能防止高温下Na(Ti)与空气中的O2(或CO2)作用,提高钛的产率;(5)根据电解原理,阴极的主要反应物和产物分别是二氧化钛和单质钛,即TiO2→Ti;由于钛元素由+4价降为0价,得到4个电子,则TiO2+4e—→Ti;由于内电路中熔融电解质中氧离子可以传导,因此用氧离子使左右电荷守恒,即TiO2+4e—→Ti+2O2—;所以,阴极反应式为TiO2+4e-=Ti+2O2-。
考点:考查化学反应原理,涉及盖斯定律、平衡常数表达式、画出温度对生成物百分含量的影响曲线、混合物分离与提纯的方法、用化学平衡移动原理解释原因、利用氧化还原反应解释原因、电解原理、熔融电解质中阴极反应式等。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
碳酸锂广泛应用于陶瓷和医药等领域,以锂辉石(主要成分为LiAlSi2O6)为原材料制备Li2CO3的工艺流程如下: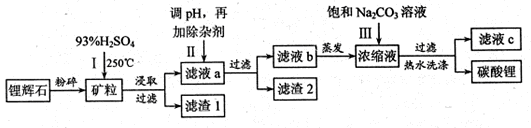
已知①2LiAlSi2O6+H2SO4 Li2SO4+Al2O3·4SiO2?H2O
Li2SO4+Al2O3·4SiO2?H2O
②Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、4.7、9.0和11.1
③某些物质的溶解度(S)如下表
请回答下列问题:
(1)锂辉石用浓硫酸浸取之前要粉碎成细颗粒的目的是 。
(2)滤液a中含有Li+、SO42-,另含有Fe3+、Al3+、Fe2+、 Mg2+ 、Ca2+ 、Na+等杂质,步骤Ⅱ需在搅拌下加入石灰石以调节溶液的PH到6.0—6.5,此时沉淀的杂质离子有 ;石灰石调节溶液PH的原理的离子方程式为 。
(3)步骤Ⅱ在滤液a中加入的除杂剂依次为适量的H2O2溶液,石灰乳和Na2CO3溶液,发生氧化还原反应的离子方程式为 。
(4)步骤Ⅲ中加入饱和Na2CO3溶液过滤后需要用热水洗涤的原因是 。
(5)从滤液c中可回收的主要物质是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(11分)Ⅰ.“中东有石油,中国有稀土”。稀土金属是我国战略性资源,应加以保护。稀土金属是周期表中ⅢB族中钪、钇和镧系十七种元素的总称,都是很活泼的金属,性质极为相似,常见化合价为+3价。钇(Y)元素是激光和超导的重要材料。我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:
已知:①有关金属离子形成氢氧化物沉淀时的pH如下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素锶(Sr)位于周期表第5周期第IIA族。碳酸锶(SrCO3)被广泛用于彩色电视机的阴极射线管。以天青石(主要成分为SrSO4,含不溶性杂质)为原料制取高纯碳酸锶的“煅烧浸取法”部分工艺流程示意如下。
(1)写出与元素锶同族第3周期元素的原子结构示意图: 。
(2)隔绝空气高温焙烧中,若0.5mol SrSO4中只有S被还原,转移了4mol电子。写出该反应的化学方程式: 。
(3)制取高纯碳酸锶过程中,常用乙醇胺(HOCH2CH2NH2)作为CO2吸收剂。乙醇胺水溶液显弱碱性(与NH3溶于水原理相似),原因是 (用离子方程式表示)。
(4)该流程中过滤2之后还有除杂等多步操作,其中最后两步是 。
(5)“低温湿法”是一种制取碳酸锶的方法:将天青石粉末与碳酸钠溶液混合,70oC下加热1~2h后,经一系列操作,得到碳酸锶。主要反应为: SrSO4(s)+CO
SrSO4(s)+CO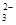 (aq) SrCO3(s)+SO
(aq) SrCO3(s)+SO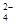 (aq)
(aq)
[已知:70oC时,Ksp(SrSO4)=3.3×10-7,Ksq(SrCO3)=1.1×10-10]
上述反应的平衡常数K= 。
(6)通过“低温湿法”得到的碳酸锶纯度较低,可能的原因是 (写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色” 消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备C1O2的流程如下:
(1)C1O2中所有原子________(填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用________
A.饱和食盐水B.碱石灰 C.浓硫酸D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是________(填选项字母)。
A.二氧化氯可广泛用于工业和饮用水处理
B.二氧化氯应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和检测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备,化学方程式为________。此法缺点主要是产率低、产品难以分离,还可能污染环境。
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式为________此法相比欧洲方法的优点是________。
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学方程式为________。此法提高了生产及储存、运输的安全性,原因是_________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸钾(K2Fe04)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,其生产工艺如下: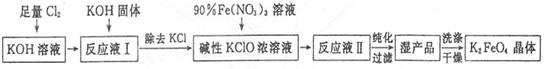
已知:2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O
回答下列问题:
(1)将Cl2通入KOH溶液中发生反应的离子方程式是____________。
(2)写出工业上制取Cl2的化学方程式____________。
(3)在“反应液I”中加入KOH固体的目的是____________。
(4)K2FeO4可作为新型多功能水处理剂的原因是____________。
(5)配制KOH溶液时,将61.6g KOH固体溶解在100 mL水中,所得溶液的密度为1.47 g ? mL-1,则该溶液的物质的量浓度为____________。
(6)从“反应液II”中分离出K2Fe04后,副产品是___________ (写化 学 式)。
(7)该工艺每得到1.98kgK2FeO4,理论上消耗Cl2的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
下列推断不合理的是 ( )。
| A.生成1 mol(NH4)2SO4至少消耗2 mol NH3 |
| B.CO2可被循环使用 |
| C.往甲中通CO2有利于(NH4)2SO4的生成 |
| D.直接蒸干滤液即可得到纯净的(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某地农田土壤胶体的胶粒带负电荷,若在该农田里施加含氮量相等的下列化肥,有效成分利用率最差的是( )
| A.(NH4)2SO4 | B.NH4HCO3 | C.NH4NO3 | D.NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
要经常向农田里施用钾肥的主要原因是( )。
| A.土壤中钾元素的含量太少,需靠施用钾肥才能满足农作物生长的需要 |
| B.土壤中钾元素的含量不少,但大多数以难溶于水的矿物质形式存在,农作物难以吸收 |
| C.土壤中钾元素的含量不少,但都易溶于水被雨淋失,需施钾肥加以补充 |
| D.钾元素是农作物生长需要量最大的元素,必须经常施钾肥加以补充 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com