
【题目】中国女药学家屠呦呦因发现青蒿素对疟疾的治疗作用而成为2015年诺贝尔生理医学奖获得者之一.下列说法不正确的是( ) 
A.从青蒿中提取青蒿素的方法是以萃取原理为基础,萃取是一种化学变化
B.青蒿素的分子式为C15H22O5 , 它属于有机物
C.人工合成青蒿素经过了长期的实验研究,实验是化学研究的重要手段
D.现代化学分析测试中,可用元素分析仪确定青蒿素中的C,H,O元素
科目:高中化学 来源: 题型:
【题目】化学与生活、生产密切相关。下列说法错误的是
A.废弃的秸秆可用于生产生物质燃料乙醇
B.硫酸钡可用于胃肠X射线造影检查
C.高纯单质硅可用于制作光导纤维
D.钙、锶、钡、铜和碱金属等金属化合物可用于制作烟花
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把18.0mol/L的浓硫酸稀释成1.8mol/L的稀硫酸100ml,实验操作如下:
(1)A. 将配好的稀硫酸倒入试剂瓶中,贴好标签;
B. 盖好容量瓶塞,反复颠倒,摇匀;
C. 用量筒取mL的18.0mol/L的浓硫酸;
D. 将沿烧杯内壁慢慢注入盛有少量的烧杯中;
E. 用少量蒸馏水洗涤烧杯2﹣3次,并将洗涤液也全部转移到容量瓶中;
F. 将已冷却至室温的硫酸溶液沿玻璃棒注入100mL的容量瓶中;
G. 改用胶头滴管逐滴加蒸馏水,使溶液凹面恰好与刻度相切;
H. 继续向容量瓶加蒸馏水,直到液面接近刻度线cm处.
填写上述步骤中的空白;
(2)请按正确的操作步骤进行排序 .
(3)试分析下列操作会使所配溶液的浓度会大于1.80mol/L浓度
A.用量筒取浓硫酸时,为了精确,用水洗涤量筒,并将洗涤液倒入烧杯中.
B.溶解后,立刻移液.
C.若加蒸馏水超过了刻度线,倒出一些溶液,再重新加蒸馏水到刻度线.
D.若定容时仰视看刻度线,会使稀硫酸溶液的浓度.
E.若摇匀后发现液面低于刻度线,又加水至刻度线.
(4)取20ml配好的硫酸,和足量的铝反应后,可收集到标准状况下的H2ml.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用如图所示装置对电解质溶液导电性进行实验探究.下列说法中正确的是( ) 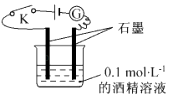
A.闭合开关K后,电流计 ![]() 指针不发生偏转,证明酒精溶液是非电解质
指针不发生偏转,证明酒精溶液是非电解质
B.闭合开关,往溶液中通入氯气,随着气体通入,电流计示数增大,故氯气是电解质
C.取用0.1 molL﹣1的蔗糖溶液替换酒精溶液,电流计的示数相同,说明蔗糖是非电解质
D.闭合开关,往烧杯中加NaCl固体,虽然固体溶解,由于不反应,故电流计指针不发生偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种清洁能源,用水煤气制取二甲醚的原理如下:
I. CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
II. 2CH3OH(g)===CH3OCH3(g)+H2O(g)
(1)300℃和500℃时,反应I的平衡常数分别为K1、K2,且K1>K2,则其正反应为______反应(填”吸热”’或”放热”)。
(2)在恒容密闭容器中发生反应I:
①下图能正确反映体系中甲醇体积分数随温度变化情况的曲线是____(填“a”或“b”)。
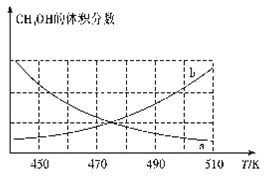
②下列说法能表明反应已达平衡状态的是____(填标号)。
A.容器中气体的压强不再变化 B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化 D.v正(H2)=2v正(CH3OH)
(3)500K时,在2L密闭容器中充入4molCO和8molH2,4min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3) ,则:
①0~4min,反应I的v(H2)=______,反应I的平衡常数K=______。
②反应II中CH3OH的转化率α=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
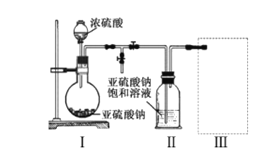
实验一 焦亚硫酸钠的制取
采用右图装置(实验前已除尽装置内的空气)制取Na2S2O5。 装置II中有Na2S2O5晶体析出,发生的反应为: Na2SO3+SO2=Na2S2O5
(1)装置1中产生气体的化学方程式为_____________________
(2)要从装置II 中获得已析出的晶体,可采取的分离方法是_____________________
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为___(填序号)。

实验二 焦亚硫酸钠的性质
已知: Na2S2O5 易被氧化,溶于水即生成NaHSO3
(4)检验Na2S2O5晶体在空气中已被氧化的实验方案是____________________。
(5)设计实验证明NaHSO3溶液中HSO3-的电离程度大于水解程度___________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。则定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,滴定终点的现象是______________________________。滴定时消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________kg/L。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果____________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com