
【题目】以下物质间的每步转化通过一步反应都能实现的是( )
A.Al→Al2O3→Al(OH)3→NaAlO2B.Fe→FeCl2→FeCl3→Fe(OH)3
C.S→SO3→H2SO4→MgSO4D.Na→Na2O→Na2O2→NaOH
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图)。下列叙述错误的是

A. 雾和霾的分散剂相同 B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂 D. 雾霾的形成与过度施用氮肥、燃料燃烧 有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiFePO4可作为新型锂离子也池的正极材料。以钛铁矿(主要成分为FeTiO3、Fe2O3及少量CuO、SiO2杂质)为主要原料生产TiOSO4,同时得到的绿矾(FeSO4·7H2O)与磷酸和LiOH反应可制各 LiFePO4, LiFePO4的制备流程如下图所示:

请回答下列问题:
(1)酸溶时 FeTiO3与硫酸反应的化学方程式可表示为____________________。
(2)①加铁屑还原的目的是__________,②过滤前需要检验还原是否完全,其实验操作可描述为_________。
(3)①“反应”需要按照一定的顺序加入FeSO4溶液、磷酸和LiOH,其加入顺序应为____________________,②其理由是______________________________。
(4)滤渣中的铜提纯后可用于制取Cu2O,Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应:2Cu+H2O![]() Cu2O+H2↑。则该装置中铜电极应连接直流电源的__________极,石墨电极的电极反应式为____________________,当有0. 1mol Cu2O生成时电路中转移__________mol电子。
Cu2O+H2↑。则该装置中铜电极应连接直流电源的__________极,石墨电极的电极反应式为____________________,当有0. 1mol Cu2O生成时电路中转移__________mol电子。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质的分类、名称(或俗名)、化学式都正确的是
A. 碱性氧化物 氧化铁 Fe3O4 B. 酸性氧化物 碳酸气 CO
C. 酸 硫酸 H2SO4 D. 碱 纯碱 Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
③CH3OH(g)![]() CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
回答下列问题:
(1)已知反应②中相关化学键键能数据如下:
化学键 | H-H | C=O | C≡O | H-O |
E/kJ·mol-1 | 436 | 803 | 1076 | 465 |
由此计算ΔH2=____kJ·mol-1。已知ΔH3=+99kJ·mol-1,则ΔH1=____kJ·mol-1。
(2)一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。

①温度为470K时,图中P点____(填“是”或“不是”)处于平衡状态。在490K之前,甲醇产率随温度升高而增大,490K之后,甲醇产率随温度升高而减小的原因分别是____。
②一定能提高甲醇产率的措施是____。
A.增大压强 B.升高温度 C.选择合适催化剂 D.加入大量催化剂
(3)如图为一定比例的CO2/H2,CO/H2、CO/CO2/H2条件下甲醇生成速率与温度的关系。

①490K时,根据曲线a、c判断合成甲醇的反应机理是____(填“I”或“II”)。
Ⅰ.CO2![]() CO
CO![]() CH3OH II.CO
CH3OH II.CO![]() CO2
CO2![]() CH3OH+H2O
CH3OH+H2O
②490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从热力学与动力学角度,并结合反应①、②分析原因____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车、工厂等污染源排入大气的碳氢化合物和氮氧化物等一次污染物,在紫外光作用下发生光化学反应生成了二次污染物。光化学烟雾是一次污染物和二次污染物的混合物。
(1)汽车尾气中含有CO、NO及碳氢化合物等。
①CO的来源是_______(用文字说明)。
②NO的来源是______(用方程式说明)。
③C8H18在汽缸中可裂解生成丙烯和戊烷等,戊烷的同分异构体有______种。
(2)文献报道了一种研究模拟光化学烟雾产生的实验,将添加丙烯和NO的空气在烟雾箱中用紫外线照射,各物质浓度的消长关系如图所示:

①下列说法正确的是_____(填标号)。
A.O3具有强氧化性 B.在光反应过程中NO最终全部转变为NO2
C.二次污染物只有乙醛 D.0~120min生成PAN的反应速率最快
②写出CH3CH=CH2被O3氧化为甲醛和乙醛的化学方程式______(注:每消耗1molO3,同时生成1molO2)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni2O3是灰黑色、有光泽的固体,主要用作陶瓷、搪瓷和玻璃的着色颜料,也可用于制备镍粉。以废镍料为原料提取Ni2O3的工艺流程如图所示。

请回答下列问题:
(1)镍的某种化合物NiOOH,其中Ni的化合价为___________。
(2)加入双氧水“氧化”的离子方程式为____________________;滤渣A的主要成分是________________(填化学式)。
(3)步骤①中为了控制“氧化”效率,最佳物质的量之比NaOH/NaClO =________。
(4)步骤②电解法制取Ni2O3,用NaOH调酸溶后溶液的pH至7.5,加入适量Na2SO4后以惰性电极电解。电解过程中产生的Cl2有约40%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。加入Na2SO4的作用__________________________;当有n mol二价镍全部转化为三价镍时,外电路中通过电子的物质的量约为____________。
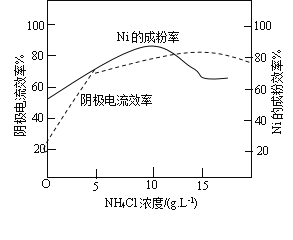
(5)工业上,镍作阳极,电解0.1molL-1NiCl2溶液与一定量NH4Cl溶液组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率(电极上实际沉积的物质的量与理论析出量之比)及Ni的成粉的影响如图所示。
① 为获得高纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为__________gL-1。
② 当NH4Cl浓度大于15gL-1时,阴极有气体生成,导致阴极电流效率降低,请结合平衡移动原理解释其原因____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com