
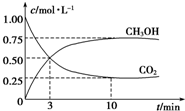
 为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,T温度下,测得CO2和CH3OH(g)的浓度随时间变化如图.请回答下列问题:
为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,T温度下,测得CO2和CH3OH(g)的浓度随时间变化如图.请回答下列问题:分析 ①由图可知,二氧化碳的浓度变化量为0.75mol/L,结合反应可知消耗H2;
②结合平衡的特征“等、定”及衍生的物理量判断;
③能使$\frac{n(C{O}_{2})}{n(C{H}_{3}OH)}$减小,使平衡正向移动;
④K为生成物浓度幂之积与反应物浓度幂之积的比,结合平衡浓度计算K,结合Qc与K判定平衡移动的方向.
解答 解:①由图可知,二氧化碳的浓度变化量为0.75mol/L,消耗c(H2)=0.75mol/L×3=2.25mol.L,H2的平衡浓度为3mol/L-2.25mol/L=0.75mol/L,
故答案为:0.75mol/L;
②A.容器内压强不再变化,可知物质的量不变,为平衡状态,故A正确;
B.质量、体积始终不变,则,密度始终不变,不能判断平衡状态,故B错误;
C.浓度保持不变,为平衡状态,故C正确;
D.单位时间内消耗3mol H2的同时生成1mol CH3OH,只体现正反应速率,不能确定正逆反应速率关系,不能判断平衡状态,故D错误;
故答案为:AC;
③A.加入催化剂,平衡不移动,$\frac{n(C{O}_{2})}{n(C{H}_{3}OH)}$不变,故A不选;
B.充入He(g),使体系压强增大,平衡不移动,$\frac{n(C{O}_{2})}{n(C{H}_{3}OH)}$不变,故B不选;
C.将H2O(g)从体系中分离,平衡正向移动,能使$\frac{n(C{O}_{2})}{n(C{H}_{3}OH)}$减小,故C选;
D.降低温度,平衡正向移动,能使$\frac{n(C{O}_{2})}{n(C{H}_{3}OH)}$减小,故D选;
故答案为:CD;
④CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的K=$\frac{c({C}_{3}HOH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始 1 3 0 0
转化 0.75 2.25 0.75 0.75
平衡 0.25 0.75 0.75 0.75
K=$\frac{0.75×0.75}{0.25×(0.75)^{3}}$=$\frac{16}{3}$,
若开始时向该1L密闭容器中充入1mol CO2,2molH2,1.5mol CH3OH和1mol H2O(g),
Qc=$\frac{1×1.5}{1×{2}^{3}}$=0.1875<$\frac{16}{3}$,平衡正向移动,
故答案为:$\frac{16}{3}$;正.
点评 本题考查化学平衡计算及图象,为高频考点,把握图中浓度变化、平衡判定、化学平衡常数K的计算为解答的关键,侧重分析与计算能力的考查,注意图象分析与应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
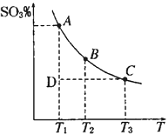 硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
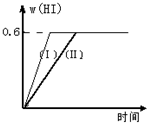 Ⅱ将1mol I2(g)和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g);△H<0,并达平衡.HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
Ⅱ将1mol I2(g)和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g);△H<0,并达平衡.HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的△H>0、△S>0 | |
| B. | 水解反应NH4++H2O?NH3•H2O+H+达到平衡后,升高温度平衡逆向移动 | |
| C. | AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 | |
| D. | 对于反应2H2O2=2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | a电极的反应为:3CO2+18H++18e-=C3H8O+5H2O | |
| B. | 该装置工作时,H+从b极区向a极区迁移 | |
| C. | 每生成1molO2,有44gCO2被还原 | |
| D. | 该装置将化学能转化为光能和电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液$\stackrel{AgNO_{3}}{→}$生成白色沉淀,则原溶液中一定含有Cl- | |
| B. | 某溶液$\stackrel{BaCl_{2}}{→}$生成白色沉淀,则原溶液中一定含有SO42- | |
| C. | 某溶液$\stackrel{Na_{2}CO_{3}}{→}$有气体产生,则原溶液中一定含有H+ | |
| D. | 某溶液$\stackrel{稀HCl}{→}$有气体产生,则原溶液中一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用100 mL量筒量取12.5 mL盐酸 | |
| B. | 用托盘天平称量5.85g食盐 | |
| C. | 需用220 mL 1 mol•L-1 CuSO4溶液,配制时需称62.5g 的CuSO4•5H2O 晶体 | |
| D. | 所配得的500 mL 0.5mol•L-1 Na2CO3溶液中,Na+的物质的量浓度为0.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
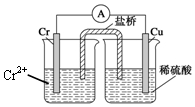 金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4).铜铬构成原电池如图所示,盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是( )
金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4).铜铬构成原电池如图所示,盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是( )| A. | 盐桥的作用是使整个装置构成通路、保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以用饱和KCl琼脂溶液 | |
| B. | 理论上1molCr溶解,盐桥中将有2molCl-进入左池,2molK+进入右池 | |
| C. | 此过程中H+得电子,发生氧化反应 | |
| D. | 电子从铬极通过导线到铜极,又通过盐桥到转移到左烧杯中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com