
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,加铜片和浓硫酸加热 | 有无色气体产生,气体遇空气可以变成红棕色 |
| (2)取少量该溶液,加BaCl2溶液 | 有白色沉淀产生 |
| (3)取(2)中上层清液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于硝酸 |
| (4)取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀溶解 |
| A. | 一定含有NO3-、SO42-和Cl- | |
| B. | 一定含有Al3+,可能含有Ba2+ | |
| C. | 一定含有NO3-、SO42-,可能含有HCO3- | |
| D. | 一定不含Fe2+、Ba2+和HCO3- |
分析 因为是无色透明溶液,所以不含有Fe2+,
由(1)取少量该溶液加热浓缩,加Cu片和浓硫酸,加热有无色气体产生,气体(NO)遇空气可以变成红棕色(二氧化氮),说明溶液中含有NO3-;
由(2)取少量该溶液,加BaCl2溶液,有白色沉淀生成,则含有SO42-,则原溶液一定不含Ba2+;
由(3)取(2)中的上层清夜,加AgNO3,有稳定的白色沉淀生成,且不溶于稀硝酸,则含有Cl-,所加的氯化钡中含有Cl-,所以原离子中的Cl-是否存在不确定;
由(4)取少量该溶液,加入NaOH溶液有白色沉淀生成,当NaOH过量时,沉淀全部溶解,则含有铝离子.
解答 解:因为是无色透明溶液,所以不含有Fe2+,
由(1)取少量该溶液加热浓缩,加Cu片和浓硫酸,加热有无色气体产生,气体(NO)遇空气可以变成红棕色(二氧化氮),说明溶液中含有NO3-;
由(2)取少量该溶液,加BaCl2溶液,有白色沉淀生成,则含有SO42-,则原溶液一定不含Ba2+;
由(3)取(2)中的上层清夜,加AgNO3,有稳定的白色沉淀生成,且不溶于稀硝酸,则含有Cl-,所加的氯化钡中含有Cl-,所以原离子中的Cl-是否存在不确定;
由(4)取少量该溶液,加入NaOH溶液有白色沉淀生成,当NaOH过量时,沉淀全部溶解,则含有铝离子,则一定不含HCO3-,
综上可知,溶液中一定存在的离子是NO3-、SO42-、Al3+,溶液中肯定不存在的离子是Ba2+、Fe2+、HCO3-;可能存在的离子为Cl-,
故选D.
点评 本题考查离子的共存问题,明确题中信息的挖掘和应用是解答的关键,并熟悉离子不能共存的常见的原因即可解答,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
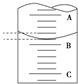 某工厂废水中含游离态氯,通过下列实验测定其浓度.
某工厂废水中含游离态氯,通过下列实验测定其浓度.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测定某溶液的pH | |
| B. | 用25 mL碱式滴定管量取14.80 mL 1 mol/L NaOH溶液 | |
| C. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 | |
| D. | 用托盘天平称取25.20 gNaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
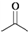 ,则
,则 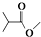 分子式:C5H8O2.
分子式:C5H8O2. .
. .
.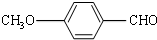 有多种同分异构体,其中属于芳香族羧酸的同分异构体共有4种,它们的结构简式是:
有多种同分异构体,其中属于芳香族羧酸的同分异构体共有4种,它们的结构简式是: 、
、 ;
; ,
, (任意两种)(任写其中二种).
(任意两种)(任写其中二种). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 | |
| B. | 2p轨道上只有一个成单电子的X原子与3p轨道上只有一个成单电子的Y原子 | |
| C. | 2p轨道上有一个空轨道的X原子与3p轨道上有一个空轨道的Y原子 | |
| D. | 最外层都只有1个电子的X、Y原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com