
| A. | 加入苛性钠溶液 | B. | 用水湿润 | C. | 加热干燥使用 | D. | 加入少量稀醋酸 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化氢易溶于水 | B. | 用CCl4 萃取碘水中的碘 | ||
| C. | 氯气易溶于NaOH溶液 | D. | 苯与水混合静置后分层 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
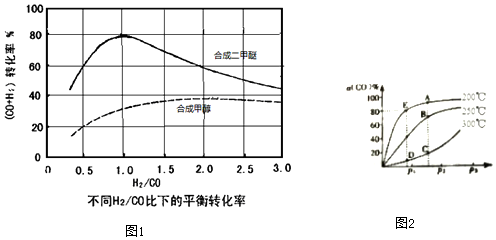
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用冰冷却苯,苯可以凝结成无色的晶体 | |
| B. | 苯与溴水混合后因发生反应而使溴水褪色 | |
| C. | 在苯中加入酸性 KMnO4 溶液,振荡后静置,上层液体为紫红色 | |
| D. | 1 mol 苯能与 3 mol H2发生加成反应,说明在苯环中含有 3 个双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 9.2g甲苯和丙三醇的混合物中,含氢原子数目为0.8NA | |
| C. | 用惰性电极电解1L浓度均为0.2mol/L的Cu(NO3)2和AgNO3的混合溶液,当有0.2NA个电子转移时,理论上阴极析出6.4g金属 | |
| D. | 电解精炼铜(粗铜含铁、锌、银、金杂质)时,每转移2NA个电子,阴极析出1 mol Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
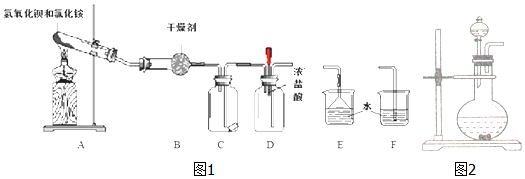
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法正确的是( )
我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法正确的是( )| A. | “吸入”CO2时,钠箔为正极 | |
| B. | “呼出”CO2时,Na+向多壁碳纳米管电极移动 | |
| C. | “吸入”CO2时的正极反应:4Na++3CO2+4e-═2Na2CO3+C | |
| D. | 标准状况下,每“呼出”22.4 L CO2,转移电子数为0.75 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 1:3 | C. | 3:2 | D. | 2:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com