
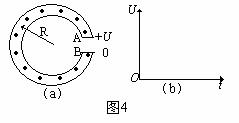
 3、如图4(a)所示为一种获得高能粒子的装置――环形加速器,环形区域内存在垂直纸面向外、大小可调节的均匀磁场。质量为m、电量为+q的粒子在环中做半径为R的圆周运动。A、B为两块中心开有小孔的极板,原来电势都为零,每当粒子飞经A板时,A板电势升高为+U,B板电势仍保持为零,粒子在两极板间的电场中得到加速。每当粒子离开时,A板电势又降为零,粒子在电场一次次加速下动能不断增大,而绕行半径不变。
3、如图4(a)所示为一种获得高能粒子的装置――环形加速器,环形区域内存在垂直纸面向外、大小可调节的均匀磁场。质量为m、电量为+q的粒子在环中做半径为R的圆周运动。A、B为两块中心开有小孔的极板,原来电势都为零,每当粒子飞经A板时,A板电势升高为+U,B板电势仍保持为零,粒子在两极板间的电场中得到加速。每当粒子离开时,A板电势又降为零,粒子在电场一次次加速下动能不断增大,而绕行半径不变。
⑴设t=0时,粒子静止在A板小孔处,在电场作用下加速,并开始绕行第一圈,求粒子绕行n圈回到A板时获得的总动能En。
⑵为使粒子始终保持在半径为R的圆轨道上运动,磁场必须周期性递增,求粒子绕行第n圈时的磁感应强度Bn。
⑶求粒子绕行n圈所需的总时间tn(设极板间距远小于R)。
⑷在图4(b)中画出A板电势u与时间t的关系(从t=0起画到粒子第四次离开B板)。
⑸在粒子绕行的整个过程中A板电势是否可始终保持+U?为什么?
解析: ⑴因粒子每绕行一圈,其增加的能量为qU,所以,绕行第n圈时获得总动能为En = nqU
⑵由⑴可求得第n圈的速度,由![]() ,得
,得![]()
在磁场中,由牛顿定律得 ![]() 即
即![]()
⑶粒子始终保持做半径为R的匀速圆周运动,所以第一圈的时间t = 2πR/v,显然因粒子能量不同,其速度也不同,粒子在第一圈运动时,有![]() 即:
即:![]()
同理,粒子在第二圈运动时,有![]() 即:
即:![]()
第n圈的速度为 ![]()
故绕行n圈所需总时间为 ![]()
 即
即 ![]()
![]()
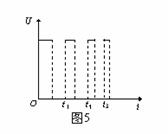
⑷A极电势U随时间t变化的图象如图5所示。
⑸不可以,因为这样会使粒子在A、B两极板之间飞行时,电场力对其做正功+qU,从而使之加速,在A、B板之外(即回旋加速器内)飞行时,电场又对其做负功 qU,从而使之减速。粒子绕行一周电场对其所做总功为零,能量不会增加。


科目:高中化学 来源: 题型:阅读理解

| 浓硫酸 |
| 加热 |
| 浓硫酸 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
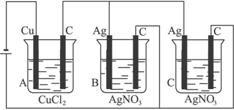
图4-14
A.0.054 g B.0.108 g C.0.216 g D.0.432 g
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在pH为4—5的环境中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生欲用电解纯净CuSO4溶液的方法,并根据电极上析出铜的质量以及电极上产生气体的体积来测定铜的相对原子质量。其实验流程如下:
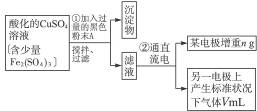
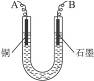
图4-16
试回答下列问题:
(1)步骤①所加入的A的化学式为________________,加入A的作用是___________________,
(2)步骤②中所用部分仪器如图4-16所示,则A应接直流电源的__________极。
(3)电解开始后一段时间,在U形管内可观察到的现象是____________,其电解总反应的离子方程式为________________________。
(4)下列实验操作属必要的是__________(填字母,下同),属不必要的是________________。
A.称量电解前电极的质量
B.电解后电极在烘干、称量前,必须用蒸馏水冲洗
C.刮下电解后电极上的铜,并清洗、称量
D.电极在烘干称量的操作必须按烘干→称量→再烘干→再称量进行两次
E.在有空气存在的情况下,电极烘干必须采用低温烘干法
(5)铜的相对原子质量为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三个电解槽,如图4-14所示(其中电极的大小、形状、间距均相同),B、C中浓度和体积相同,当通电一段时间后,如若A中铜电极的质量增加0.128 g时,B中电极上银增加的质量为( )
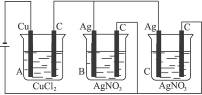
图4-14
A.0.054 g B.0.108 g C.0.216 g D.0.432 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com