
| n |
| V |
| 1.806g |
| 1.840g |


科目:高中化学 来源: 题型:
| A、化肥的合理使用,缓解了人类粮食危机 |
| B、绿色化学的快速发展,减轻了环境污染 |
| C、新材料的研制和应用,提高了人们的生活品质 |
| D、化石燃料的直接利用,促进了“低碳”经济的发展 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A.吸收NH3,并防止倒吸用 | B.除去自来水中的Fe3+获得纯净水 | C.从KI和I2的固体混合物中回收I2 | D.苯提取溴水中的Br2 |
 | 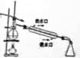 |  |  |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
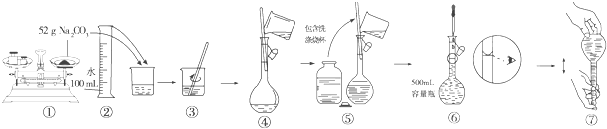
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、检验CO32-,可取少量试剂滴加稀盐酸,若产生无色无味的气体能使澄清石灰水变浑浊,则说明原溶液中一定有CO32- |
| B、检验SO42-,可取少量试剂滴加氯化钡溶液,若产生白色沉淀,则说明原溶液中有SO42- |
| C、用氢氧化钠溶液可除去CO2气体中的HCl气体 |
| D、为除去粗盐中的Ca2+、Mg2+、SO42-可依次加入过量的BaCl2、NaOH、Na2CO3后过滤,再加入适量的稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+ Na+ Cl- NO3- |
| B、Cu2+ H+ HCO3- Cl- |
| C、Na+ Ba2+ Cl- SO42- |
| D、Fe2+ H+ NO3- ClO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com