
| 表1 | 表2 | |||
| 物质 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) |
| Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
| Fe2+ | 5.8 | 8.8 | NiF | 可溶 |
| Al3+ | 3.0 | 5.0 | CaF2 | 难溶 |
| Ni2+ | 6.7 | 9.5 | NiCO3 | KSP=9.60×10-6 |
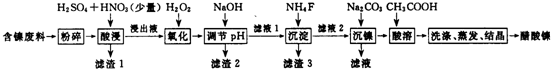
分析 含镍废料(含 NiS、Al2O3、FeO、CaO、SiO2)粉碎,加硫酸和硝酸酸浸,过滤,滤渣1为二氧化硅和硫酸钙,浸出液含有Ni2+、Fe2+、Al3+、Ca2+,加H2O2把亚铁离子氧化为Fe3+,然后加NaOH调节pH,使Al3+、Fe3+转化为沉淀,同时Ni2+不能转化为沉淀,所以调节pH的范围5.0≤pH<6.7,过滤,滤渣2为氢氧化铁和氢氧化铝,滤液中含有Ni2+、Ca2+,再加氟化铵,生成CaF2沉淀,过滤,滤渣3为CaF2,滤液中加碳酸钠生成NiCO3沉淀,过滤,滤渣中加醋酸溶解,生成(CH3COO)2Ni溶液,然后蒸发浓缩、冷却结晶得到(CH3COO)2Ni固体;
(1)调节pH使Al3+、Fe3+转化为沉淀,根据表中的数据分析;
(2)根据流程分析;
(3)加H2O2把亚铁离子氧化为Fe3+;
(4)酸浸过程中,1mol NiS失去6NA个电子,同时生成两种无色有毒气体,则生成NO和SO2;
(5)已知NiCO3的Ksp=9.6×10-4,使100ml该滤液中的Ni2+沉淀物完全,即[c(Ni2+)≤10-5mol•L-1],求出碳酸根离子的浓度,然后求出其物质的量和质量;
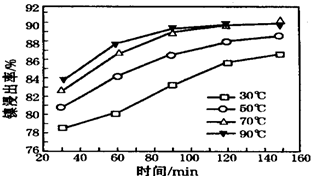
(6)根据图象中不同温度、时间下酸浸出率分析.
解答 解:含镍废料(含 NiS、Al2O3、FeO、CaO、SiO2)粉碎,加硫酸和硝酸酸浸,过滤,滤渣1为二氧化硅和硫酸钙,浸出液含有Ni2+、Fe2+、Al3+、Ca2+,加H2O2把亚铁离子氧化为Fe3+,然后加NaOH调节pH,使Al3+、Fe3+转化为沉淀,同时Ni2+不能转化为沉淀,所以调节pH的范围5.0≤pH<6.7,过滤,滤渣2为氢氧化铁和氢氧化铝,滤液中含有Ni2+、Ca2+,再加氟化铵,生成CaF2沉淀,过滤,滤渣3为CaF2,滤液中加碳酸钠生成NiCO3沉淀,过滤,滤渣中加醋酸溶解,生成(CH3COO)2Ni溶液,然后蒸发浓缩、冷却结晶得到(CH3COO)2Ni固体;
(1)调节pH使Al3+、Fe3+转化为沉淀,同时Ni2+不能转化为沉淀,根据表中的数据可知,调节pH的范围为5.0≤pH<6.7;
故答案为:5.0≤pH<6.7;
(2)由流程分析可知,滤渣1为二氧化硅和硫酸钙,滤渣3为CaF2;
故答案为:SiO2、CaSO4;CaF2;
(3)溶液中的亚铁离子不容易转化为沉淀,加H2O2把亚铁离子氧化为Fe3+,反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(4)酸浸过程中,1mol NiS被硝酸氧化失去6NA个电子,同时生成两种无色有毒气体,则生成NO和SO2,其反应的化学方程式为:NiS+H2SO4+2HNO3═NiSO4+SO2↑+2NO↑+2H2O;
故答案为:NiS+H2SO4+2HNO3═NiSO4+SO2↑+2NO↑+2H2O;
(5)已知NiCO3的Ksp=9.6×10-6,使100ml该滤液中的Ni2+沉淀物完全,即[c(Ni2+)≤10-5mol•L-1],
则溶液中c(CO32-)=$\frac{Ksp}{c(N{i}^{2+})}$=$\frac{9.6×1{0}^{-6}}{1{0}^{-5}}$mol/L=0.96mol/L,与Ni2+反应的n(CO32-)=cV=2mol/L×0.1L=0.2mol,
则加入的碳酸钠的总物质的量n(CO32-)=0.2mol+0.96mol/L×0.1L=0.296mol,
所以m=nM=0.296mol×106g/mol=31.4g,
故答案为:31.4;
(6)由图象可知,为70℃、120min时,酸浸出率最高,故答案为:70;120.
点评 本题考查了物质分离提纯基本操作和综合应用、溶度积常数的有关计算,题目难度中等,侧重于考查学生的分析能力和计算能力,注意把握常见物质或离子的分离提纯方法.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
时间s 浓度mol/L | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
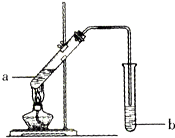 如图为实验室制备乙酸乙醋的装置.
如图为实验室制备乙酸乙醋的装置.| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 乙醇 | -114 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | 338 | 1.84 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
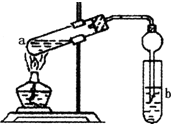 如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.
如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
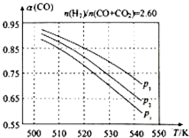 甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:| 物质 | CO | CO2 | H2 | CH3OH(g) |
| 标准生成热(kJ/mol) | -110.52 | -393.51 | 0 | -201.25 |
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |||
| CH3OH(g) | CH3OCH3(g) | H2O(g) | CH3OCH3(g) | H2O(g) | ||
| a | 387 | 0.20 | 0 | 0 | 0.080 | 0.080 |
| b | 387 | 0.40 | 0 | 0 | ||
| c | 207 | 0.20 | 0 | 0 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
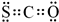
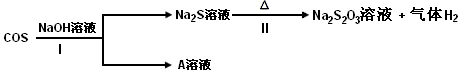
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com