
ij��Һ�п��ܺ���H+��Na+��NH4+��Mg2+��Fe3+��Al3+��SO42����HCO3�������ӣ��������Һ�м���һ�����ʵ���Ũ�ȵ�NaOH��Һʱ���������ɳ������ʵ�����NaOH��Һ������仯��ͼ��ʾ������˵����ȷ����
��������
| �� | A�� | ab�η��������ӷ�ӦΪ��Al3++3OH��=Al��OH��3����Mg2++2OH��=Mg��OH��2�� |
| �� | B�� | ԭ��Һ�к��е������ӱض���H+��NH4+��Al3+��Mg2+ |
| �� | C�� | ԭ��Һ�к��е�Fe3+��Al3+�����ʵ���֮��Ϊ1��1 |
| �� | D�� | d����Һ�к��е�����ֻ��NaAlO2 |
| ���ӷ���ʽ���йؼ��㣮. | |
| ������ | ����ͼ���һ�Σ������������ϳ��֣���֪һ���������ӣ�����кͷ�Ӧ��һ�з�Ӧ�����ȷ�Ӧ�����ɳ����ں����ܽ�һ���֣�һ���������ӣ����ݵ����Σ����������Ʒ�Ӧ�����Ӳ�����������֤����笠����ӣ�������������ɳ�������6������������ƣ��������������ܽ�����һ������������ƣ������γ���������������������������ƣ��������������������һ���DZ��������������ģ�����һ���������������ӣ�һ������̼��������Ӻ�þ���ӣ���ԭ��Һ�к��е���������H+��NH4+��Fe3+��Al3+���ݴ˻ش��жϣ� |
| ��� | �⣺����ͼ���һ�Σ������������ϳ��֣���֪һ���������ӣ�����кͷ�Ӧ��һ�з�Ӧ�����ȷ�Ӧ�����ɳ����ں����ܽ�һ���֣�һ���������ӣ����ݵ����Σ����������Ʒ�Ӧ�����Ӳ�����������֤����笠����ӣ�������������ɳ�������6������������ƣ��������������ܽ�����һ������������ƣ������γ���������������������������ƣ��������������������һ���DZ��������������ģ�����һ���������������ӣ�һ������̼��������Ӻ�þ���ӣ���ԭ��Һ�к��е���������H+��NH4+��Fe3+��Al3+�� A��ab�η��������ӷ�ӦΪ��Al3++3OH��=Al��OH��3����Fe3++3OH��=Fe��OH��3������A���� B��ԭ��Һ�к��е���������H+��NH4+��Fe3+��Al3+����B���� C��������������ɳ�������6������������ƣ��������������ܽ�����һ������������ƣ������γ���������������������������ƣ��������������������һ���DZ��������������ģ�����һ���������������ӣ����е�Fe3+��Al3+�����ʵ���֮��Ϊ1��1����C��ȷ�� D��d����Һ�к��е�������NaAlO2������NH3•H2O����D���� ��ѡC�� |
| ������ | ������һ���й����Ӽ�����ۺ�֪ʶ��Ŀ������ǶȺܹ㣬�ѶȽϴ� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��һ���¶��£����ܻ����ﱥ����Һ������Ũ�ȵij˻�Ϊһ���������������
��һ���¶��£����ܻ����ﱥ����Һ������Ũ�ȵij˻�Ϊһ��������������� 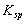 ��ʾ����֪��
��ʾ����֪��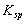 (AgCl) = = 1.8��10��10��
(AgCl) = = 1.8��10��10��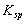 (Ag2CrO4) = 2 = 1.9��10��12
(Ag2CrO4) = 2 = 1.9��10��12
����0.001 mol��L��1 AgNO3��Һ�ζ�0.001 mol��L��1 KCl��0.001 mol��L��1 ��K2CrO4�Ļ����Һ����ͨ������ش�
��1��Cl����CrO42�� �����ȳ���?
��2����CrO42�� �� Ag2CrO4 ��ʽ����ʱ����Һ�е�Cl�� ����Ũ���Ƕ���? CrO42�� ��Cl�� �ܷ�ﵽ��Ч�ķ���?���赱һ�����ӿ�ʼ����ʱ����һ������Ũ��С��10��5 mol��L��1 ʱ������Ϊ���Դﵽ��Ч���룩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NAΪ����٤��������ֵ������˵����ȷ���� �� ��
A��0.1molN2��0.3molH2���ܱ��������������³�ַ�Ӧ�����ɰ�������Ϊ0.2NA
B����״���£�11.2L��ȩ�����е�����Ϊ8NA
C�����³�ѹ�£�7.8g���к��е�������ĿΪ0.9NA
D��1LŨ��Ϊ1mol��L��1��Na2CO3��Һ�к���NA��CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ʾ�����;����ѧ֪ʶ���õõ�����ʹ�������������ã���������������Ӧ�õĶ�Ӧ��ϵ��ȷ���ǣ�������
| �� | A�� | ������۵��Ӳ�ȴ����������뵼����� |
| �� | B�� | Ũ����������ԣ������ڿ�ʴ������Ʒ |
| �� | C�� | Ư���ڿ����в��ȶ���������Ư��ֽ�� |
| �� | D�� | �����������������ԣ���������θ���кͼ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���б�ʾ��Ӧ��ѧ��Ӧ�����ӷ���ʽ��ȷ���ǣ�������
| �� | A�� | ������SO2ͨ��������ˮ�У�SO2+2NH3•H2O�T2NH4++SO32�� |
| �� | B�� | ʵ������Cu��ϡHNO3��Ӧ��ȡ����NO���壺Cu+4H++NO3���TCu2++NO��+2H2O |
| �� | C�� | NaHSO4��Һ��Ba��OH��2��Һ��Ӧ�����ԣ�2H++SO42��+Ba2++2OH���TBaSO4��+2H2O |
| �� | D�� | KIO3��KI��������Һ�з�Ӧ��5I��+IO3��+3H2O�T3I2+6OH�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ������ѧ��Ӧ����ʽΪ��A+B��X+Y+H2O��δ��ƽ����Ӧ������ȥ�������У�A��B�����ʵ���֮��Ϊ1��4����ش�
��1����YΪ����ɫ���壬�÷�Ӧ�����ӷ���ʽΪ������B���ֳ��Ļ�ѧ������������
��2����AΪ�����ķǽ������ʣ�B����ҺΪijŨ�ᣬ��Ӧ����Ϊ���ȣ��䷴Ӧ�Ļ�ѧ����ʽΪ������
��3����AΪij�����õĽ������ʣ��÷�Ӧ�ܲ���һ����ɹ⻯ѧ���������壬�÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ����
��4����AΪ�����Ľ������ʣ�������A��B��Ũ��Һ�С��ۻ�������A������X��Һ�У�д��A��X����Һ��Ӧ�����ӷ���ʽ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʵ�顰�����������롰���ۡ�����ȷ����
| ���������� | ���� | |
| A | �п������ƣ��Ʊ��������ɫ������ȥ | Na�ڿ����л�����Na2O2 |
| B | ��������Ũ�����У����������� | ����Ũ�����Ӧ |
| C | ��FeCl2��Һ�μӵ���������KMnO4��Һ�У���Һ��ɫ | FeCl2����Ư���� |
| D | ��Fe(NO3)2��Һ�еμ�ϡ�����KSCN��Һ����Һ��ɺ�ɫ | ��Һ����Fe3+���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ�������£�2SO2(g)+O2(g) 2SO3(g) ��H��0���й�������ȷ����
2SO3(g) ��H��0���й�������ȷ����
A�������¶ȣ�v(��)���v(��)��С
B�����º��ݣ�����O2��02��ת��������
C�����º�ѹ������N2��ƽ�ⲻ�ƶ�
D�����º��ݣ�ƽ��ǰ����������ܶȱ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʵ�鲻�ܴﵽԤ��Ŀ�ĵ���
| ��� | ʵ����� | ʵ��Ŀ�� |
| A | Ũ��ϡHNO3�ֱ���Cu��Ӧ | �Ƚ�Ũ��ϡHNO3��������ǿ�� |
| B | ��ʢ��1mL��������Һ���Թ��еμ�NaCl��Һ���������г������ɣ��������еμ�Na2S��Һ | ˵��һ�ֳ�����ת��Ϊ��һ���ܽ�ȸ�С�ij��� |
| C | �ⶨ��Ũ�ȵ�HCl��HNO3����Һ��pH | �Ƚ�Cl��N�ķǽ�����ǿ�� |
| D | �����£��ֱ���2֧�Թ��м�����ͬ�������ͬŨ�ȵ�Na2S2O3��Һ���ٷֱ������ͬ�����ͬŨ�ȵ�ϡ���� | �о�Ũ�ȶԷ�Ӧ���ʵ�Ӱ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com