
| A. | 2n(C)+n(N)+2 | B. | 2n(C)+2n(N)+n(O) | C. | 3n(C)+2n(O)+2 | D. | 2n(C)+2n(N)+2 |
分析 根据要使H原子最多,分子中就不能有双键,n(C)最多能结合2n(C)+2个H(烷烃),n(N)最多能结合n(N)+2个H原子(可以推导出:NH3、NH2-NH2、NH2-NH-NH2、…),碳链和氮链连在一起,各自还要去掉2个H,当O作为-OH存在时,H原子数目最多,且O的存在不影响H原子的个数来分析;
解答 解:要使H原子最多,分子中就不能有双键,n(C)最多能结合2n(C)+2个H(烷烃),n(N)最多能结合n(N)+2个H原子(可以推导出:NH3、NH2-NH2、NH2-NH-NH2、…),碳链和氮链连在一起,各自还要去掉1个H,当O作为-OH存在时,H原子数目最多,且O的存在不影响H原子的个数,所以形成一个分子中,最多有H原子:2n(C)+2+n(N)+2-2=2n(C)+n(N)+2;
故选A.
点评 本题考查了有机物的结构,掌握成键时各原子之间的数量关系是解题的关系,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 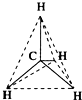 结构示意图 | B. |  电子式 | C. | 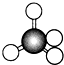 球棍模型 | D. | 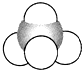 比例模型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL12mol/L浓盐酸与足量的MnO2加热充分反应生成氯气分子数为0.3 NA | |
| B. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA | |
| C. | 向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA | |
| D. | 5.4g铝粉与足量的氢氧化钠溶液充分反应生成氢气分子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的比例模型: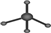 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 醛基的电子式: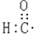 | D. | 甲醛的结构式: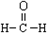 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
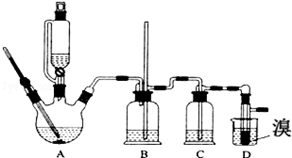
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 操作方法 | 实验现象 | 结论或解释 |
| 1 | 观察氯水的颜色 | 含有Cl2 | |
| 2 | 有无色气体产生 | 含有H+ | |
| 3 | 取少量氯水于试管中,加入稀硝酸酸化的硝酸银溶液 | 有白色沉淀生成 | |
| 4 | 取少量氯水于试管中,放入红色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
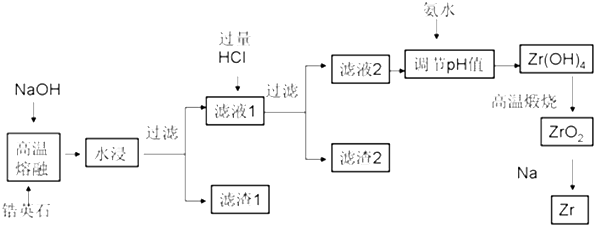
| 沉淀物 | Zr(OH)4 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时pH | 1.2 | 2.7 | 3.4 | 6.3 |
| 完全沉淀时pH | 2.4 | 3.2 | 5.2 | 9.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com