
 下列叙述中正确的是( )
下列叙述中正确的是( )| A. | 该分子中所有原子共面 | |
| B. | 该分子可与FeCl3溶液反应呈紫色 | |
| C. | 1mol该物质最多可与4molH2发生反应 | |
| D. | 1mol该分子最多可与4mol溴发生反应 |
分析 分子中含有酚羟基,可发生取代、氧化和颜色反应,含有碳碳双键,可发生加成、加聚和氧化反应,以此解答该题.
解答 解:A.分子中含有CH2原子团,具有甲烷的结构特点,所有原子不可能在同一个平面上,故A错误;
B.含有酚羟基,可与FeCl3溶液反应呈紫色,故B正确;
C.能与氢气发生加成反应的为苯环和碳碳双键,则1mol该物质最多可与4molH2发生反应,故C正确;
D.分子中含有1个酚羟基,有2个邻位氢原子可被取代,且碳碳双键可与溴发生加成反应,则1mol胡椒酚最多可与3mol溴发生反应,故D错误.
故选BC.
点评 本题考查有机物的结构和性质,为高考常见题型和高频考查,侧重于学生的分析能力的考查,注意把握有机物的结合特点和官能团的性质,为解答该题的关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化学式 | 碳酸 | 醋酸 |
| 电离常数 | K1=4.4×10-7K2=4.7×10-11 | K=1.75×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入甲醇的电极是电池的正极 | |
| B. | 电池工作时氧气发生氧化反应 | |
| C. | 电池负极反应式为O2+4H++4e-═2H2O | |
| D. | 电池工作后电解质溶液碱性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
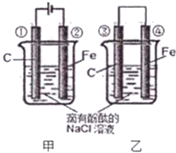 化学能和电能的相互转化是能量转化的重要形式,电池在现代生活的很多方面得到广泛应用.
化学能和电能的相互转化是能量转化的重要形式,电池在现代生活的很多方面得到广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学反应的快慢和限度对人类生产生活有重要的意义.
化学反应的快慢和限度对人类生产生活有重要的意义.| 实例 | 影响条件 |
| ①食物放在冰箱里能延长保质期 | |
| ②工业炼铁时,把铁矿石预先粉碎后,再进行炼制 | |
| ③用H2O2分解制O2,加入MnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Zn为负极,Cu为正极 | B. | 正极反应式为:Zn-2e-═Zn2+ | ||
| C. | 负极反应式为:Cu-2e-═Cu2+ | D. | 该装置能将电能转化为化学能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com