
| A. | NO3- | B. | SO42- | C. | Na+ | D. | H+ |
分析 无色溶液,一定不含Fe3+,向其中滴加酚酞试液不变红色,则溶液显酸性,一定含H+,不能存在OH-、CO32-,结合三种离子的物质的量相等及溶液为电中性来解答.
解答 解:无色溶液,一定不含Fe3+,向其中滴加酚酞试液不变红色,则溶液显酸性,一定含H+,不能存在OH-、CO32-,
由三种离子的物质的量相等及溶液为电中性可知,
溶液中存在H+、Na+、SO42-,1×1+1×1=1×2遵循电荷守恒,存在SO42-时,溶液中不能存在Ba2+,而存在NO3-不满足题意,则不含NO3-,
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,注意溶液电中性为解答的易错点,题目难度中等.


科目:高中化学 来源: 题型:解答题
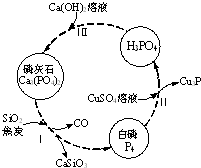 磷及部分重要化合物的相互转化如图所示.
磷及部分重要化合物的相互转化如图所示.| 成分 | CaO | P2O5 | SO3 | CO2 |
| 质量分数(%) | 47.30 | 28.40 | 3.50 | 6.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
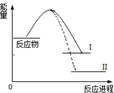
| A. | 1molN≡N键能与3molH-H键能之和大于6molN-H键能,所以反应为放热 | |
| B. | N2(g)+3H2(g)?2NH3(l)+Q2反应历程的能量变化如曲线Ⅱ,则Q2>Q1 | |
| C. | 选择合适的催化剂,可以降低反应所需温度,Q1值也相应减少 | |
| D. | 2mol氨气的能量高于1mol氮气和3mol氢气的能量之和,所以反应需要高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是极性分子 | |
| B. | 都是共价化合物 | |
| C. | 共价分子间的作用力都比化学键弱 | |
| D. | 溶于水的共价分子都能产生自由移动的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com