
【题目】(1)一定温度下,在恒容密闭容器中NO2与O2反应为4NO2(g)+O2(g)![]() 2N2O5(g)。(不考虑NO2的分解 ) 若已知该反应是放热反应,则K550℃___K350℃,(填“大于” “等于”或“小于”)。反应达平衡后,若再通入一定量NO2,则平衡常数K将_______,NO2的转化率______。(填“增大”“减小”或“不变”)
2N2O5(g)。(不考虑NO2的分解 ) 若已知该反应是放热反应,则K550℃___K350℃,(填“大于” “等于”或“小于”)。反应达平衡后,若再通入一定量NO2,则平衡常数K将_______,NO2的转化率______。(填“增大”“减小”或“不变”)
(2)若初始时在恒容密闭容器中加入N2O5,下表为N2O5分解反应在一定温度下不同时间测得N2O5浓度的部分实验数据:
t/s | 0 | 500 | 1000 |
c(N2O5) mol/L | 5.00 | 3.25 | 2.48 |
①写出该反应的平衡常数表达式:K=____________。
②1000s内N2O5的分解速率为:_____________。
③若每有1 mol N2O5分解,吸收Q kJ的热量,写出该分解反应的热化学方程式____。
④能使4NO2(g)+O2(g)![]() 2N2O5(g)反应速率增大,且平衡向正反应方向移动的是(_______)
2N2O5(g)反应速率增大,且平衡向正反应方向移动的是(_______)
a.及时分离出N2O5 b.适当提高温度 c.增大O2浓度 d.选择高效催化剂
【答案】小于 不变 减小 ![]() 0.00252mol/(Ls) 2N2O5(g)=4NO2(g)+O2(g) △H=+2Q kJmol-1 c
0.00252mol/(Ls) 2N2O5(g)=4NO2(g)+O2(g) △H=+2Q kJmol-1 c
【解析】
(1)反应是放热反应,温度升高,化学平衡向吸热的逆反应方向移动,平衡常数减小;若再通入一定量NO2,二氧化氮转化率减小,平衡常数只随温度变化,温度不变平衡常数不变;
(2)①依据化学方程式书写平衡常数;
②依据反应速率概念计算应用;
③每有1mol N2O5分解,吸收Q kJ的热量,分解2mol N2O5分解,吸收2Q kJ的热量,标注物质聚集状态和对应反应的焓变写出热化学方程式;
④依据化学平衡移动原理和反应特征分析。
(1)一定温度下,在恒容密闭容器中NO2与O2反应为4NO2(g)+O2(g)![]() 2N2O5(g),不考虑NO2的分解,已知该反应的正反应是放热反应,根据平衡移动原理:升高温度,化学平衡向吸热的逆反应方向移动,平衡常数减小,所以K550℃<K350℃;若再通入一定量NO2,增大反应物的浓度,可以透过其它反应物氧气的平衡转化率,但二氧化氮本身的转化率减小;由于平衡常数只与温度有关,温度不变,化学平衡常数就不变;
2N2O5(g),不考虑NO2的分解,已知该反应的正反应是放热反应,根据平衡移动原理:升高温度,化学平衡向吸热的逆反应方向移动,平衡常数减小,所以K550℃<K350℃;若再通入一定量NO2,增大反应物的浓度,可以透过其它反应物氧气的平衡转化率,但二氧化氮本身的转化率减小;由于平衡常数只与温度有关,温度不变,化学平衡常数就不变;
(2)①化学平衡常数等于生成物浓度的幂次方乘积与反应物平衡浓度的幂次方乘积的比,所以反应2N2O5(g)![]() 4NO2(g)+O2(g)的平衡常数表达式K=
4NO2(g)+O2(g)的平衡常数表达式K=![]() ;
;
②1000s内N2O5的消耗物质的量浓度=5.00mol/L-2.48mol/L=2.53mol/L,故N2O5的分解速率=![]() =0.00252mol/(Ls);
=0.00252mol/(Ls);
③每有1mol N2O5分解,吸收Q kJ的热量,分解2mol N2O5分解,吸收2Q kJ的热量,则该反应的热化学方程式:2N2O5(g)=4NO2(g)+O2(g) △H=+2Q kJmol-1;
④能使4NO2(g)+O2(g)![]() 2N2O5(g)反应速率增大,且平衡向正反应方向移动;
2N2O5(g)反应速率增大,且平衡向正反应方向移动;
a.及时分离出N2O5,平衡正向进行,但由于物质的浓度降低,化学反应速率减小,a不符合题意;
b.适当提高温度,反应速率增大,由于该反应的正反应是放热反应,升高温度,化学平衡逆向移动,b不符合题意;
c.增大O2浓度,反应速率增大,平衡正向进行,c符合题意;
d.选择高效催化剂,增大反应速率,但由于对正、逆反应速率影响相同,因此不能使化学平衡发生移动,d不符合题意;
故合理选项是c。


科目:高中化学 来源: 题型:
【题目】准确配制一定浓度的NaCl溶液时,下列操作会使配制溶液浓度偏低是( )
A.使用的砝码已生锈
B.定容时仰视容量瓶的刻度线
C.容量瓶使用前未烘于,底部有少量蒸馏水残留
D.转移操作后,将使用的烧杯及玻璃棒多次用蒸馏水洗涤,并将洗涤液转移至容量瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肌红蛋白(Mb)可与O2结合生成MbO2:![]() 。37℃时测得肌红蛋白的结合度(α)与p(O2)的关系如下表。
。37℃时测得肌红蛋白的结合度(α)与p(O2)的关系如下表。
已知:K=![]()
[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的物质的量分数]
p(O2)/kPa | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
α(MbO2)% | 50.0 | 66.7 | 80.0 | 85.7 | 88.9 | 90.9 | 92.3 |
(1) 37℃时,若空气中氧气分压为21.0 kPa,则人正常呼吸时α的最大值为________%(保留1位小数)。
(2) 温度不变时,游客在山顶时体内MbO2的浓度比在山下________(填“高”或“低”)。
(3) 研究发现,v正=k正·c(Mb)·p(O2),v逆=k逆·c(MbO2)。已知37℃时k逆=60 s-1,则k正=_________(注明速率常数单位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳碳单键可以绕键轴自由旋转,结构简式为如图所示的烃,下列说法中正确的是( )
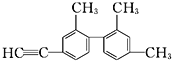
A. 分子中处于同一直线上的碳原子最多有6个
B. 该烃苯环上的二氯代物共有13种
C. 该烃的一氯代物共有8种
D. 分子中至少有12个碳原子处于同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】mg气体A和ng气体B的分子数相等,下列说法不正确的是( )
A.同体积的气体A和气体B的质量比为m:n
B.25℃时,1kg气体A和1kg气体B的分子数比为n: m
C.同温同压时气体A和气体B的密度比为n:m
D.标况时,等质量的A和B气体的体积比为n:m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用如下的方法从海水中提溴:
浓缩海水![]() 粗产品溴
粗产品溴![]() 溴蒸气
溴蒸气![]() 物质X
物质X![]() 产品溴
产品溴
完成下列填空:
(1)上述流程中有两步都涉及到氯气。写出氯元素在周期表中的位置:_______;足量氯气与铁反应生成氯化铁,足量碘与铁反应生成碘化亚铁。运用原子结构和元素周期律简要说明导致产物中铁元素价态不同的原因________。
(2)和氯元素位于同主族的另外一个短周期元素单质的电子式是:___,两者气态氢化物的稳定性是:_______>_______(填写化学式)。
(3)步骤②中体现了溴具有的性质是_______(文字简述)。
(4)写出步骤③中反应的离子方程式(说明:此反应在水溶液中进行):_______;
(5)溴蒸汽还可以用饱和碳酸钠溶液来吸收,产物为NaBr、NaBrO3,同时放出CO2,请写出该反应的化学方程式并标明电子转移方向与数目:_______。
(6)用上述方法制得的液溴常溶有少量氯气,除去氯气的方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

A. 图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B. 图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
C. 图丙表示催化剂能改变化学反应的焓变
D. 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)![]() N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ag纯净的碳酸钠和ag碳酸钠与碳酸氢钠的混合物相比,下列描述正确的是( )
A.分别和盐酸反应时,混合物的耗酸量大
B.分别和足量盐酸反应时,混合物放出的CO2多
C.分别配制成等体积溶液,混合物碱性大
D.分别配制成等体积溶液,混合物的Na+的物质的量大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2,其反应过程可表示为:
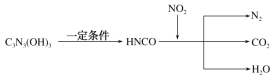
下列说法正确的是( )
A.反应中NO2是还原剂
B.C3N3(OH)3与HNCO为同一物质
C.HNCO与NO2反应的化学计量数之比为3:4
D.反应过程中,每1 mol NO2参加反应,转移电子4 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com