
| A、H2Y的电离方程式:H2Y?2H++Y2- |
| B、HY-的水解方程式:HY-+H2O?H3O++Y2- |
| C、该酸式盐溶液中离子浓度关系:c(Na+)>c(HY-)>c(OH-)>c(H+) |
| D、该酸式盐溶液中离子浓度关系:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

 )和CH2=CH2为原料制备有机物
)和CH2=CH2为原料制备有机物 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
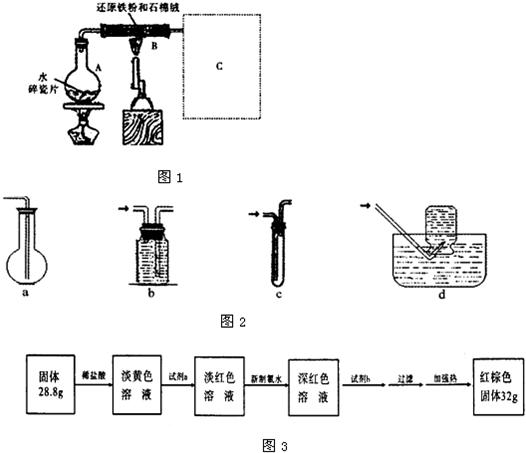
查看答案和解析>>
科目:高中化学 来源: 题型:


| 400℃ |
| 约1250℃ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) |
| B、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
| C、物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH) |
| D、0.1mol/L 的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在潮湿的酸性土壤中 |
| B、在潮湿不透气的中性土壤中 |
| C、在干燥致密不透气的土壤中 |
| D、在潮湿透气的盐碱地中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaCl2+Na2SO4═BaSO4↓+2NaCl | ||||
| B、Cl2+2NaBr═Br2+2NaCl | ||||
| C、NH4HC03═NH3↑+H2O+CO2 | ||||
D、CaCO3
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ag+、Na+、Cl-、NO3- |
| B、Na+、K+、OH-、SO42- |
| C、K+、Na+、CO32-、Cl- |
| D、Ba2+、Mg2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2浓度不变 |
| B、正反应速率大于逆反应速率 |
| C、正反应速率等于逆反应速率 |
| D、正反应速率小于逆反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com