
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于![]() (一种固体催化剂)合成
(一种固体催化剂)合成![]() 的原理示意图如图。下列说法错误的是
的原理示意图如图。下列说法错误的是

A. 氧化剂与还原剂的物质的量之比为3:1
B. 该过程中涉及极性键和非极性键的断裂与生成
C. 基于![]() 合成
合成![]() 的过程属于氮的固定
的过程属于氮的固定
D. 工业中,氨经一系列反应可以得到硝酸
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】利用软锰矿(主要成分为 MnO2,含有杂质 SiO2、Fe2O3)和高品质硫锰矿(主要成 分为 MnS)制取 KMnO4 的一种工艺流程如下图所示。

请回答下列问题:
(1) “酸浸”工序中,MnO2和 MnS中的 Mn元素转化成 MnSO4,同时生成 S 单质,该反应的离子方程式为________________________________________。
(2)为了提高“酸浸”效率,下列方法可行的是_______________________。
A. 将软锰矿和硫锰矿矿石研磨成矿粉 B. 适当提高体系的温度
C. 使用浓盐酸代替稀硫酸进行酸浸 D. 使用搅拌器对混合物进行搅拌
(3)将“滤液Ⅰ”进行处理后,在温度为 50℃,pH 为 6.4~6.8 的电解槽中持续电解,可使 NaClO3复原,同时获得的副产物是 H2,则阳极的电极反应式为______________________________。
(4) “歧化”时,生成物为 K2CO3、KMnO4 和 MnO2。可通过过滤操作分离出 MnO2,并将其循环 到___________工序,以提高原料利用率。然后通过蒸发浓缩、降温结晶、过滤、洗涤、低 温 烘 干 操 作 获 得 KMnO4 固体 , 洗 涤 时 应 使 用 75% 乙 醇 溶 液 对 固 体 进 行 冲 洗 , 其 优 点是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物在生产、生活中都有重要的应用:

(Ⅰ)现实验室要配置一定物质的量浓度的稀盐酸。
(1)如图是某市售盐酸试剂瓶标签上的部分数据。则该盐酸的物质的量浓度是___ mol·L-1。
(2)某同学用该浓盐酸配制100mL 1mol·L-1的稀盐酸。请回答下列问题:
①通过计算可知,需要用量筒量取浓盐酸 ____ mL。
②使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有_______。
③若配制过程遇下列情况,溶液的物质的量浓度将会:(填“偏高”“偏低”“无影响”)
A.量取的浓盐酸置于烧杯中较长时间后配制______。
B.转移溶液前,洗净的容量瓶内壁附有水珠而未干燥处理___。
C.定容时俯视容量瓶的刻度线_____。
(Ⅱ)实验室使用浓盐酸、二氧化锰共热制氯气,并用氯气和氢氧化钙反应制取少量漂白粉(该反应放热)。已知:MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O;氯气和氢氧化钙在温度较高时会生成副产物氯酸钙。甲、乙、丙三位同学分别设计了三个实验装置如下图所示:
MnCl2 + Cl2↑+ 2H2O;氯气和氢氧化钙在温度较高时会生成副产物氯酸钙。甲、乙、丙三位同学分别设计了三个实验装置如下图所示:
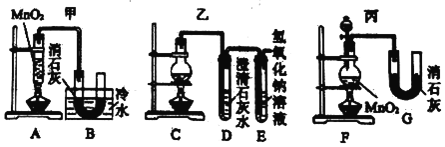
(1)哪位同学的装置能够有效地防止副反应的发生?_____。
(2)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成。从上述甲、乙、丙三套装置中选出合理的部分(按气流从左至右的流向)组装一套较完善的实验装置(填所选部分的字母)_____。
(3)利用(2)中实验装置进行实验,实验中若用12 mol·L-1的浓盐酸200 mL与足量二氧化锰反应,最终生成的次氯酸钙的物质的量总小于0.3 mol,其可能的主要原因是_____(假定各步反应均无反应损耗且无副反应发生)。
(Ⅲ)已知HClO的杀菌能力比ClO-强。25℃时将氯气溶于水形成氯气一氯水体系,该体系中Cl2、HClO和ClO-的物质的量分数(a)随pH变化的关系如图所示。
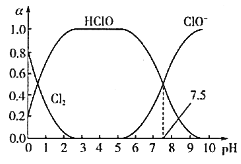
由图分析,欲使氯水的杀菌效果最好,应控制的pH范围是__,当pH=7.5时,氯水中含氯元素的微粒有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列转化关系,回答有关问题:

已知CH3CHO在一定条件下可被氧化为CH3COOH。
(1)A的结构简式为________,C试剂是________,砖红色沉淀是________(填化学式)。
(2)B溶液的作用是__________。
(3)④和⑥反应的化学方程式及反应类型分别为:
④_______, _______________。
⑥________, _________。
(4)由图示转化关系可知淀粉________(填“部分水解”或“完全水解”)。某同学取图中混合液E,加入碘水,溶液不变蓝色,________(填“能”或“不能”)说明淀粉水解完全,原因是__________。若向淀粉中加入少量硫酸,并加热使之发生水解,为检验淀粉水解的情况所需的试剂是________。(填序号)
①NaOH溶液 ②新制Cu(OH)2悬浊液 ③BaCl2溶液 ④碘水
(5)在进行蔗糖的水解实验并检验水解产物中是否含有葡萄糖时,某同学的操作如下:取少量纯蔗糖加水配成溶液,在蔗糖溶液中加入3~5滴稀硫酸,将混合液煮沸几分钟、冷却,在冷却后的溶液中加入新制Cu(OH)2悬浊液,加热,未见砖红色沉淀。其原因是________(填字母)。
a.蔗糖尚未水解
b.蔗糖水解的产物中没有葡萄糖
c.加热时间不够
d.煮沸后的溶液中没有加碱液无法中和稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①CO(g)+CuO(s)![]() CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s)![]() Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=c(CO2).c(Cu)/c(CO).c(CuO)
B. 反应③的平衡常数K=K1/K2
C. 对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,lmolCH3OH与一定量O2发生反应时,生成CO、CO2或HCHO的能量变化如下图所示[反应物O2(g)和生成物H2O(g)已略去]。

回答下列问题:
(1)在有催化剂作用下,CH3 OH与O2反应主要生成 ___(填“CO2、CO或HCHO”);计算:2HCHO(g)+O2(g)=2CO(g)+2H2O(g)![]() =_____________
=_____________
(2)已知:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g) ![]()
①经测定不同温度下该反应的平衡常数如下:

该反应为 ___(填“放热”或“吸热”)反应;250℃时,某时刻测得该反应的反应物与生成物浓度为c(CO) =0.4mol/L、c(H2) =0. 4mol/L、c(CH3 OH) =0. 8mol/L,则此时υ(正)____υ(逆)(填“>”、“=”或“<”)。
②某温度下,在体积固定的2L密闭容器中将1molCO和2molH2混合,使反应得到平衡,实验测得平衡时与起始时的气体压强比值为0 .7,则该反应的平衡常数为____(保留l位小数)。
(3)利用钠碱循环法可除去SO2。常温下,若吸收液吸收一定量SO2后的溶液中,n(SO32-):n(HSO3-) =3:2,则此时溶液呈____(填“酸性”、“中性”或“碱性”)。(已知:H2SO3的电离常数为:Kal=l. 54×10-2、Ka2=l. 02×l0-7)
(4)利用电化学法处理工业尾气SO2的装置如图所示,写出Pt(2)电极反应式:______;当电路中转移0. 02 mol e-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加___ mol离子。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A,B,C,D,E五种元素,其中A,B,C,D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为csccpc+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D.
(1)上述元素中,第一电离能最小的元素的原子结构示意图为__;D的价电子排布图为__;
(2)下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.

则在以上分子中,中心原子采用sp3杂化形成化学键的是__(填写分子的化学式); 在③的分子中有__个σ键和__个π键.
(3)A,C,D可形成既具有离子键又具有共价键的化合物,其化学式可能为__;足量的C的氢化物水溶液与CuSO4溶液反应生成的配合物,其化学式为__,请说出该配合物中中心原子与配位体及内界与外界之间的成键情况:__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法一定正确的是( )

(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
A. 分子晶体中都存在共价键
B. CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C. SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D. 金属晶体的熔点都比分子晶体的熔点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中Cl-浓度与50 mL 1 mol·L-1AlCl3溶液中Cl-浓度相等的是( )
A. 150 mL 1 mol·L-1的NaCl溶液B. 75 mL 2 mol·L-1NH4Cl溶液
C. 150 mL 2 mol·L-1的KCl溶液D. 100 mL 1.5mol·L-1的MgCl2溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com