
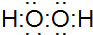 .
. .
. .
. .
.分析 (1)双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
(2)氯化镁为离子化合物,必须标出阴阳离子的电子式;
(3)氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起;
(4)用短线“-”代替共用电子对即为结构式,结构式只把共用电子对用短线表示,未成键的电子不画出;
(5)甲烷是正四面体结构,分子中C-H键的键角为109°28′.
解答 解:(1)双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,故答案为:
,故答案为: ;
;
(2)氯化镁为离子化合物,化学式中存在阴阳离子,其电子式中需要标出阴阳离子所带电荷,氯化镁的电子式为: ,故答案为:
,故答案为: ;
;
(3)氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ,故答案为:
,故答案为: ;
;
(4)乙烷的结构式为: ,故答案为:
,故答案为: ;
;
(5)甲烷分子是以碳原子为中心的正四面体结构,甲烷分子中4个C-H完全相同,C-H键的键角为109°28′,故答案为:109°28′.
点评 本题考查常用化学用语的书写,难度不大,掌握常用化学用语的书写,注意共价键形成的物质未成键孤对电子对容易忽略.


 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝与NaOH溶液反应:Al+6OH-═[Al(OH)4]-+H2↑ | |
| B. | 向AlCl3溶液中滴入过量氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| C. | Al2O3与NaOH溶液反应:Al2O3+2OH-+3H2O═2[Al(OH)4]- | |
| D. | Ba(OH)2溶液与明矾溶液反应至Al3+完全沉淀:Ba2++3OH-+Al3++SO42-═Al(OH)3↓+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,0.2mol•L-1的一元酸HCl与等浓度的MOH溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是( )
常温下,0.2mol•L-1的一元酸HCl与等浓度的MOH溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是( )| A. | MOH为强碱 | |
| B. | 该混合液pH=7 | |
| C. | 该混合溶液中:c(Cl-)=c(M+) | |
| D. | 图中X表示M+,Y表示H+,Y表示MOH,R表示OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 戊二醛的分子式为C5H8O2,符合此分子式的二元醛有5种 | |
| B. | 戊二醛不能使酸性高锰酸钾溶液褪色 | |
| C. | 戊二醛经催化氧化可以得到的戊二酸有4种同分异构体 | |
| D. | 1mol的戊二醛与足量的银氨溶液反应,最多可得2mol单质银 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com