
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:________。
(2)用盐酸酸浸时,为使酸浸速率加快,可采取的一种措施是:____________________,发生反应的离子方程式为:____________________________________。
(3)流程中通过过滤得到草酸氧化钛钡晶体,过滤操作中使用的玻璃仪器有:______________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:___________________________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:___________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol·L-1,则c(CO32-)在浸出液中的最大浓度为:_________mol·L-1。
【答案】+4 适当增大盐酸浓度;适当升高温度;减小BaCO3粒径等合理即可 BaCO3 + 2H+ = Ba2+ + CO2 + H2O 漏斗、烧杯、玻璃棒 促进TiCl4水解 60% 2.58×10-8
【解析】
在酸性条件下,将碳酸钡溶解,向浸出液中加入TiCl4、草酸溶液。经过过滤得到草酸氧化钛钡晶体,洗涤煅烧后得到BaTiO3,据此分析;
(1)BaTiO3中Ba的化合价为+2价,O的化合价为-2价,根据化合物中元素的正负化合价代数和为0,Ti元素的化合价为+4价,因此,本题答案为:+4;
(2)适当增大盐酸浓度、适当升高温度、减小BaCO3粒径都可以使酸浸速率加快;盐酸酸浸时反应的化学方程式为BaCO3 + 2HCl = BaCl2 + CO2↑ + H2O ,离子方程式为:BaCO3 + 2H+ = Ba2+ + CO2↑+ H2O。因此,本题答案为:适当增大盐酸浓度;适当升高温度;减小BaCO3粒径等合理即可;BaCO3 + 2H+ = Ba2+ + CO2↑+ H2O;
(3)过滤操作中使用的玻璃仪器有烧杯、漏斗、玻璃棒;
(4) TiCl4水解的离子方程式为TiCl4+2H2O=TiO2+4HCl ,加入大量水促进TiCl4水解,盐的水解是吸热过程,加热促进TiCl4水解,故制备时加入大量的水同时加热,目的是促进TiCl4的水解。因此,本题答案为:促进TiCl4水解;
(5)根据Ba元素守恒,理论上得到BaTiO3的质量为19.7g/197(g/mol)×233g/mol=23.3g, BaTiO3的产率为13.98g/23.3g×100%=60%,因此,本题答案为:60%;
(6)BaCO3的溶解平衡方程式为BaCO3(s) Ba2+(aq)+CO32-(aq),Ksp(BaCO3)=c(Ba2+)×c(CO32-)=2.58×10-9,若浸出液中c(Ba2+)=0.1mol/L,则CO32-在浸出液中最大浓度c(CO32-)=2.58×10-8mol/L,因此,本题答案为:2.58×10-8;


科目:高中化学 来源: 题型:
【题目】如图装置电解一段时间,当某极析出0.32gCu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化及气体的溶解忽略不计)
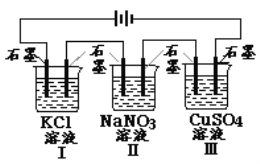
A. 13、7、1 B. 12、7、2
C. 1、7、13 D. 7、13、1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种有机光电材料中间体。由A制备G的一种合成路线如下:

回答下列问题:
(1)F中的官能团名称为______。
(2)B的分子式为C9H8O,写出B的结构简式:______。
(3)反应②~⑥中属于取代反应的是______(填序号)。
(4)写出同时满足下列条件的C的一种同分异构体的结构简式:______。
Ⅰ.能发生银镜反应; Ⅱ.分子中含有苯环且有4种不同化学环境的氢。
(5)请写出以![]() 和CH3C≡CH为原料制备
和CH3C≡CH为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)______。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 足量的KI溶液与FeCl3溶液反应后,用CCl4萃取其中的I2,分液,在水溶液中滴加KSCN溶液仍呈血红色,说明该反应有一定的限度
B. 在一定条件下,一份双氧水样品经过2 h,H2O2的浓度从0.05 mol·L-1下降到0.03 mol·L-1,H2O2在这2 h中分解的平均反应速率约为0.015 mol·L-1·h-1
C. 其他条件相同时,反应温度升高,对于吸热反应,反应速率加快,对于放热反应,反应速率减慢
D. 一定条件下,固定体积的容器中发生反应A(g)+B(g) ![]() 2C(g),当容器内A、B、C的浓度之比为1∶1∶2时,该反应处于平衡状态
2C(g),当容器内A、B、C的浓度之比为1∶1∶2时,该反应处于平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类研究氢能源从未间断过,而热化学循环分解水制 H2是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为H2和O2,这是一种节约能源、节省反应物料的技术,下图是热化学循环制氢气的流程:
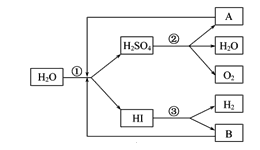
(1)实验测得,1 g H2燃烧生成液态水放出142.9 kJ的热量,则表示氢气燃烧热的热化学方程式为_______。
(2)整个流程参与循环的物质是________和________(填化学式),最难进行的反应是____________(填序号)。
(3)汞虽然有毒,但用途广泛。用汞和溴化钙作催化剂,可以在较低温度下经过下列反应使水分解制氢气和氧气:①CaBr2+2H2O=Ca(OH)2+2HBr↑;②……③HgBr2+Ca(OH)2=CaBr2+HgO+H2O;④2HgO=2Hg+O2↑。反应②的化学方程式为________________________。
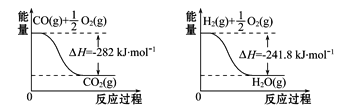
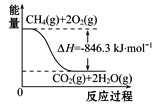
(4)合成氨用的H2可以甲烷为原料制得。有关化学反应的能量变化如图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3+5O2![]() 4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是( )
4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是( )
A. v(NO)=0.1 mol·(L·s)-1 B. v(NO)=0.02 mol·(L·s)-1
C. v(NH3)=0.01 mol·(L·s)-1 D. v(NH3)=0.2 mol·(L·s)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①CO(g)+CuO(s)![]() CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s)![]() Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=c(CO2).c(Cu)/c(CO).c(CuO)
B. 反应③的平衡常数K=K1/K2
C. 对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原子结构和元素周期律的表述正确的是( )
A.原子序数为15的元素的最高化合价为+3
B.ⅦA族元素是同周期中非金属性最强的元素
C.第二周期ⅣA族元素的原子核电荷数和中子数一定为6
D.I A族元素的金属性一定比ⅡA族元素的金属性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com