

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | A1(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
| 11.2L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10Q | B、10Q~5Q |
| C、大于10Q | D、5Q |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
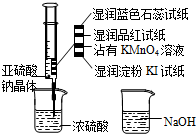 如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )| A、蓝色石蕊试纸先变红后褪色 |
| B、NaOH溶液可用于除去实验中多余的SO2 |
| C、湿润淀粉KI试纸未变蓝说明SO2的氧化性强于I2 |
| D、品红试纸、沾有KMnO4溶液滤纸均褪色都能证明SO2的漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
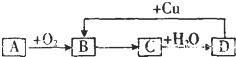 如图,A~D四种物质均含有同一种元素,A是非金属单质,D是最高价氧化物对应的水化物,则A、B、C、D中共同含有的元素可能是( )①C ②N ③Si ④S ⑤Cl.
如图,A~D四种物质均含有同一种元素,A是非金属单质,D是最高价氧化物对应的水化物,则A、B、C、D中共同含有的元素可能是( )①C ②N ③Si ④S ⑤Cl.| A、①② | B、②⑤ | C、③④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com